
某种元素四价氧化物与同价氯化物的化学式式量之比为2∶7,则该元素的相对原子质量是________,该元素原子核内有6个中子,原子序数为________,元素名称为________.
科目:高中化学 来源: 题型:
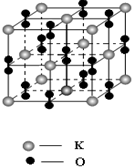 氧气是化工生产的重要原料,很多金属和非金属都能和氧气直接作用.
氧气是化工生产的重要原料,很多金属和非金属都能和氧气直接作用.| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/kJ?mol-1 | 3791 | 3410 | 3223 | 3054 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/kJ?mol-1 | 3791 | 3410 | 3223 | 3054 |
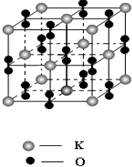
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com