
| A. | CH3-CH2-C≡CH | B. | CH2=CH-CH=CH2 | C. | 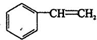 | D. | 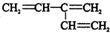 |
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行判断.
解答 解:A、CH3-CH2-C≡CH中含有一个甲基,甲基具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故A符合;
B、乙烯为平面结构,CH2=CH-CH=CH2中所有碳原子可能处在同一平面上,故B不符合;
C、乙烯为平面结构,苯是平面型结构, 中苯环上的碳原子处于乙烯中H原子位置,所有碳原子可能处在同一平面上,故C不符合;
中苯环上的碳原子处于乙烯中H原子位置,所有碳原子可能处在同一平面上,故C不符合;
D、乙烯为平面结构,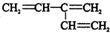 中所有碳原子可能处在同一平面上,故D不符合.
中所有碳原子可能处在同一平面上,故D不符合.
故选A.
点评 本题主要考查了学生对有机物的共面知识的认识,难度较大,分析时可根据已学过的甲烷、乙烯、苯的结构来类比判断.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的苯所含的分子个数为0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含原子个数为2.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子个数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直链烷烃中,碳原子数越多沸点越高 | |
| B. | 碳原子数相同的烷烃,支链越多沸点越高 | |
| C. | 相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃 | |
| D. | 碳原子数相同的醇,羟基越多沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
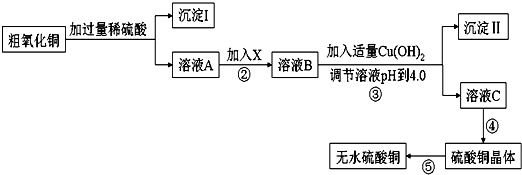
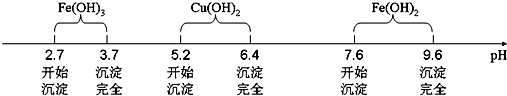
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
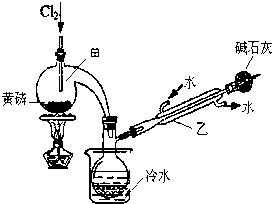
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com