
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
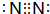 ,物质甲分子的结构式
,物质甲分子的结构式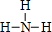 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24L CO 和O2 混合气体中含有的碳原子数目为0.1NA | |
| B. | 常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA | |
| C. | 常温常压下,48g O3含有的分子数为3NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ,其核磁共振氢谱中有2个吸收峰.
,其核磁共振氢谱中有2个吸收峰.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g•cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂.某实验小组的同学用右图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置己略去),主要操作步骤如下:
邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g•cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂.某实验小组的同学用右图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置己略去),主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验现象 |
| ①将镁带用砂纸擦后,放入试管中,加入少量水后,加热至水沸腾;再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②将一小块金属钠放入滴有酚酞试液的冷水反应 | (B)反应不十分剧烈,产生的气体可在空气中燃烧 |
| ③镁带与2mol/L的稀盐酸反应 | (C)剧烈反应,产生的气体可在空气中燃烧 |
| ④铝条与2mol/L的稀盐酸反应 | (D)生成白色胶状沉淀,继而沉淀消失 |
| ⑤向AlCl3溶液滴加NaOH溶液 | (E)产生大量气体,可在空气中燃烧,溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验操作 | 现象 |
① | 向大试管中加入20mL 0.1mol?L-1的Na2S溶液 (已知Na2S溶液显碱性,pH约为12),再滴加5mL 0.1mol?L-1的FeCl3溶液,边滴边振荡 | 产生大量黑色沉淀,反应后溶液仍显碱性 |
② | 向另一支大试管中加入20mL 0.1mol?L-1FeCl3溶液(已知FeCl3溶液显酸性,pH约为2),再滴加5mL 0.1mol?L-1的Na2S溶液,边滴边振荡 | 局部有黑色沉淀但瞬间消失,溶液颜色变浅,并产生大量黄色浑浊,反应后溶液仍显酸性 |
| 实验操作 | 预期现象和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com