
为了综合利用副产品CaSO4,某化工厂与相邻的合成氨厂联合设计了下列(NH4)2SO4生产流程:
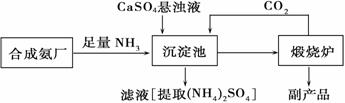
请回答以下问题:
(1)合成氨反应的化学方程式是 ,该反应在 (填设备名)中发生,反应所用催化剂一般用 。
(2)沉淀池中发生的主要反应方程式是 ,该反应能够发生的原因是 。
(3)在上述流程中可以循环使用的物质是 ,该生产过程中的副产品是 。
(4)从绿色化学和资源综合利用的角度说明上述流程的主要优点是 。
科目:高中化学 来源: 题型:
利用反应6NO2+8NH3===7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
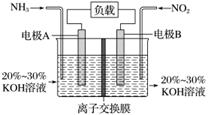
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阳离子交换膜
C.电极A极反应式为2NH3-6e-===N2+6H+
D.当有4.48 L NO2(标准状况)被处理时,转移电子为0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。SnSO4的实验室制备设计路线如下:
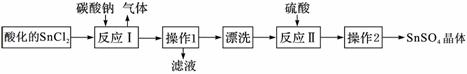
下列有关说法正确的是
A.SnCl2酸化是为了防止溶解时发生水解
B.反应I中发生的离子反应为:CO32-+2H+=CO2↑+ H2O
C.漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2~3次
D.操作1为过滤,操作2为结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸在一定的条件下反应制得。
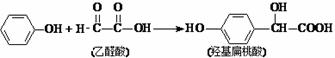
下列有关说法正确的是学
A.该反应是取代反应
B.苯酚和羟基扁桃酸遇上FeCl3溶液都会显色
C.乙醛酸与H2加成的产物能在催化剂作用下形成高分子化合物
D.1 mol羟基扁桃酸能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列材料都具有一定的特殊性能,其中是由长周期的主族元素和副族元素形成的是
| A、透明陶瓷材料硒化锌 | B、SO2和O2反应的催化剂五氧化二钒 |
| C、半导体材料砷化镓 | D、吸氢材料镧镍合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键 ②共价化合物一定含共价键,也可能含离子键 ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤由分子组成的物质中一定存在共价键 ⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)CH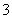 、—CH3(甲基)、CH
、—CH3(甲基)、CH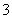 都是重要的有机反应中间体,有关它们的说法正确的是________。
都是重要的有机反应中间体,有关它们的说法正确的是________。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH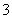 与NH3、H3O+互为等电子体,几何构型均为三角锥形
与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH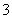 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3(甲基)或一个CH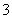 和一个CH
和一个CH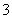 结合均可得到CH3CH3
结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置:第________周期第________族,属于________区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式________________________________________________________________________;
葡萄糖分子[CH2OHCHOH(CHOH)3CHO]中碳原子杂化方式有________。
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键。
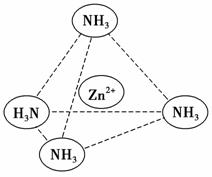
查看答案和解析>>
科目:高中化学 来源: 题型:
元素原子中最小的;B元素原子最外层的电子数 比D的最外层电子数多1个;C元素是短周期中金属性最强的元素;D的单质是重要的半导体材料。请回答:
比D的最外层电子数多1个;C元素是短周期中金属性最强的元素;D的单质是重要的半导体材料。请回答:
(1)写出以上元素名称A 、B 、C 、D
(2)写出B在周期表中的位置是: 。
(3)写出D的氧化物与C的最高价氧化物对应水化物反应的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com