
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
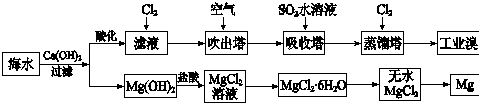
分析 海水中加入氢氧化钙沉淀镁离子后过滤,在滤液中通入CL2是将滤液中的Br-氧化为Br2,再利用热的空气将Br2吹出,进入吸收塔与SO2反应,其反应的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-;再通入CL2将Br-氧化为Br2,两次Br-→Br2转化的目的是对溴元素进行富集,氢氧化镁加入盐酸溶解得到氯化镁溶液,氯化镁溶液中得到氯化镁晶体的 操作是加热蒸发冷却结晶得到无水氯化镁,电解熔融氯化镁得到金属镁;
(1)提取溴的过程中,经过2次Br-→Br2转化的目的是更多的得到溴单质;吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,在蒸馏塔中被氯气氧化得到更多的溴单质;通空气的目的是溴单质被空气带出;
(2)氢氧化镁和盐酸反应生成氯化镁溶液;
(3)氯化镁溶液中得到氯化镁晶体,电解熔融氯化镁得到金属镁和氯气;
(4)依据离子方程式计算得到需要的氯气体积.
解答 解:(1)依据利用海水可以提取溴和镁,流程中提取溴的过程中,经过2次Br-→Br2转化的目的是更多的得到溴单质,提取过程对溴元素进行富集;吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,在蒸馏塔中被氯气氧化得到更多的溴单质,吸收塔中反应的离子方程式为;SO2+Br2+2H2O=4H++2Br-+SO42-;
故答案为:对溴元素进行富集;SO2+Br2+2H2O=4H++2Br-+SO42-;
(2)氢氧化镁和盐酸反应生成氯化镁溶液,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(3)从MgCl2溶液中得到MgCl2固体,电解熔融氯化镁得到金属镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(4)若将10m3海水中的溴元素转化为工业溴,依据图表中溴元素含量为64mg/L,10m3海水中含溴元素=10×1000L×64g/L×10-3=640g;物质的量=$\frac{640g}{80g/mol}$=8mol,依据反应计算得到:2Br-+Cl2=Br2+2Cl-,消耗氯气物质的量为:4mol;提取过程中需要两次通入氯气实现溴离子被氧化,所以至少需要标准状况下Cl2的物质的量为8 mol标准状况下体积为 8mol×22.4L/mol=179.2L,
故答案为:179.2.
点评 本题考查了海水淡化的电渗析原理的分析判断,海水中溴的提取过程,溶液中得到固体的条件应用,反应过程中的氧化剂计算,注意氯气两次氧化消耗,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 63.47 | B. | 64.47 | C. | 63.57 | D. | 64.57 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯都能与水发生加成反应 | |
| B. | 实验室制溴苯时选用的试剂可以是溴水、苯和铁屑 | |
| C. | 配制银氨溶液时,将氨水逐滴加到 AgNO3溶液中,边加边振荡,直至沉淀恰好完全消失 | |
| D. | 银镜反应实验后试管内壁附有银,可用稀硫酸清洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油和花生油都可发生皂化反应 | |
| B. | 蚕丝、棉、麻、的主要成分都是纤维素 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 加热马铃薯可使其中的淀粉变成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于稀硝酸中:2Al+6H+=2A13++3H2↑ | |
| B. | 碳酸钡与稀硫酸反应:Ba2++SO42-=BaSO4↓ | |
| C. | 碳酸氢钠溶液与少量盐酸反应:CO32-+2 H+=H2O+CO2↑ | |
| D. | 碳酸钠溶液缓慢滴入少量稀盐酸:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与W相邻的同主族元素可制成重要的半导体材料 | |
| B. | 元素的原子半径从大到小的顺序是X、Y、Z | |
| C. | WZ4分子中W、Z 原子最外层均达到8电子结构 | |
| D. | W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 | 0.075 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 | -3 |
| A. | T的氢化物水溶液呈酸性 | |
| B. | L、M的单质与稀盐酸反应速率:M>L | |
| C. | R的氢化物H2R分子中有10个电子 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
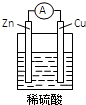
| A. | 铜片是负极 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从锌片经导线流向铜片 | |
| D. | 有6.02×1022个电子经过导线时,锌片质量减少3.25g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com