
| 51.2g |
| 64g/mol |
| 51.2g |
| 64g/mol |
| 2.6mol |
| 10mol/L |
| 0.2mol |
| 0.50L |
| 1.6mol |
| 2 |
| ||
| 4 |


科目:高中化学 来源: 题型:
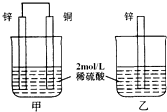 如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )
如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )| A、甲和乙中的反应不同 |
| B、甲为原电池,H+向正极移动 |
| C、甲中铜片表面的c(H+)比乙中锌片表面的c(H+)高 |
| D、若将2mol/L稀硫酸改为2mol/LCuSO4溶液,则乙中溶液更快褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
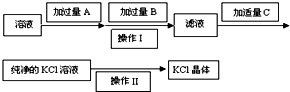 为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
14 7 |
23 11 |
24 12 |
7 3 |
14 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com