
在标准状况下,11.2 L甲烷和22.4 L氧气混合后点燃,恢复到原状况时,气体的体积共( )
A.11.2 L B.22.4 L
C.33.6 L D.44.8 L
科目:高中化学 来源: 题型:
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由镍原子构成,另一种由镍原子和镁原子一起构成,两种八面体的数量比是1︰3,碳原子只填充在镍原子构成的八面体空隙中。
(1)画出该新型超导材料的一个晶胞(碳原子用小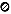 球,镍原子用大○球,镁原子用大
球,镍原子用大○球,镁原子用大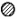 球)。
球)。
(2)写出该新型超导材料的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y两种元素的原子的质子数之和为20,两元素形成的化合物在水溶液中能电离出电子层结构相同的阴、阳离子,则X、Y形成的化合物是( )
A.MgF2 B.NaF
C.LiCl D.Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
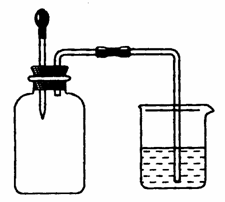
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④
C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列各组物质:
A.C60和C240
B. C和
C和 C
C
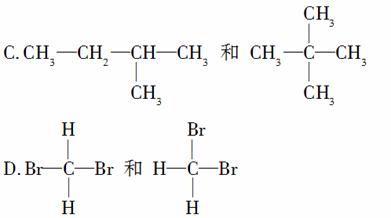
E.甲烷和庚烷
(1)________组两物质互为同位素;
(2)________组两物质互为同素异形体;
(3)________组两物质互为同系物;
(4)________组两物质互为同分异构体;
(5)________组两物质是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.3 B.4
C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是( )
A.1.4 g B.2.2 g
C.4.4 g D.在2.2 g和4.4 g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验研究中经常用到定量分析。
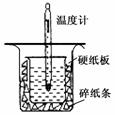 I.取0.55 mol/L的NaOH溶液50mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
I.取0.55 mol/L的NaOH溶液50mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
(1)从右图实验装置看,装置中的一个明显错误是
。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值
会_________,(填“偏大”、“偏小”、“ 不变”)
(3)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55 mol·L-1NaOH 溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”),简述理由 。
Ⅱ.某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
 请回答:
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致
测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:________________,且半分钟内不变色。
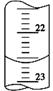
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com