
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含最/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
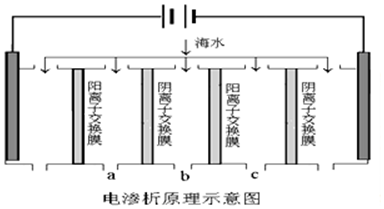
| A. | 电解一段时间后阴极区会发生反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 阳极的电极反应式为2H2O-4e-═O2↑+4H+ | |
| C. | 电解时b室中阴离子移向a室,阳离子移向c室 | |
| D. | 淡水的出口为b出口 |
分析 A.开始电解时,阳极上氯离子放电生成氯气,阴极上水得电子生成氢气同时生成OH-,生成的OH-和HCO3-反应生成CO32-,Ca2+转化为CaCO3沉淀;
B.Cl-放电能力大于OH-;
C.阴(阳)离子交换膜只允许阴(阳)离子通过;
D.电解时b室中阴离子移向a室,阳离子移向c室,所以b室中物质主要是水.
解答 解:A.开始电解时,阳极上氯离子放电生成氯气,阴极上水得电子生成氢气同时生成OH-,生成的OH-和HCO3-反应生成CO32-,Ca2+转化为CaCO3沉淀,所以电解一段时间后阴极区会发生反应:Ca2++OH-+HCO3-═CaCO3↓+H2O,故A正确;
B.Cl-放电能力大于OH-,所以阳极的电极反应式为2Cl--2e-═Cl2↑,故B错误;
C.阴(阳)离子交换膜只允许阴(阳)离子通过,所以电解时b室中阴离子移向a室,阳离子移向c室,故C正确;
D.电解时b室中阴离子移向a室,阳离子移向c室,所以b室中物质主要是水,则淡水的出口为b出口,故D正确;
故选B.
点评 本题考查电解原理,为高频考点,明确离子放电顺序及离子之间的反应是解本题关键,知道各个室产生物质成分,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Mg | C. | 稳定性:HF>CH4 | D. | 酸性:HF<HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10%的葡萄糖溶液加入新制氢氧化铜悬浊液中,加热可得到砖红色沉淀 | |
| B. | 苯加入到溴水中,苯和溴发生取代反应而使溴水褪色 | |
| C. | 在洁净的试管中加入1~2 mL AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
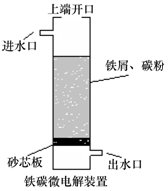
| A. | 无论是否鼓入空气,负极的电极反应式均为Fe-2e-═Fe2+ | |
| B. | 不鼓入空气时,正极的电极反应式为H++e-═H | |
| C. | 鼓入空气时,每生成1mol•OH有2mol电子发生转移 | |
| D. | 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
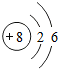 ,b的最简单氢化物的电子式为
,b的最简单氢化物的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 290 | 39 | 11.7 |
| 实验Ⅰ | 实验Ⅱ | |
| 通入气体 | CO、H2 | CO、H2、H2O(g) |
| 固体产物 | Fe3O4、Fe | Fe3O4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C、D三种元素形成的化合物一定是共价化合物 | |
| B. | 工业上常用电解E与F形成的化合物的方法制取单质E | |
| C. | 原子半径由大到小的顺序:D>C>B>A | |
| D. | B、C、F元素最高价氧化物水化物酸性最强的是F |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com