
根据题目提供的溶度积数据进行计算并回答下列问题:
(1)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________。
(2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________。
②完全沉淀后,溶液的pH=__________。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?____________(填“是”或“否”)。
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为__________________。
答案 (1)蓝色
(2)①1.0×10-7 mol·L-1 ②2 ③否
(3)4×10-3 mol·L-1
解析 (1)设Mg(OH)2饱和溶液中c(OH-)为x mol·L-1,则0.5x3=5.6×10-12,x>1×10-4,c(H+)<1×10-10 mol·L-1,pH>10,溶液为蓝色。(2)①反应前,n(Ag+)n(Ag+)=0.018 mol·L-1×0.05 L=0.9×10-3 mol,n(Cl-)=0.020 mol·L-1×0.05 L=1×10-3 mol;反应后剩余的Cl-为0.1×10-3 mol,则混合溶液中,c(Cl-)=1.0×10-3 mol·L-1,c(Ag+)=Ksp(AgCl)/c(Cl-)=1.0×10-7 mol·L-1。②H+没有参与反应,完全沉淀后,c(H+)=0.010 mol·L-1,pH=2。③因为加入的盐酸中c(Cl-)和反应后所得溶液中的c(Cl-)相同,c(Cl-)没有改变,c(Ag+)变小,所以Qc=c(Ag+)·c(Cl-)<Ksp(AgCl),没有沉淀产生。
(3)根据Ksp(FeS)得:c(S2-)=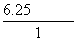 =6.25×10-18mol·L-1,根据c2(H+)·c(S2-)=1.0×10-22得:c(H+)=
=6.25×10-18mol·L-1,根据c2(H+)·c(S2-)=1.0×10-22得:c(H+)= 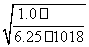
=4×10-3 mol·L-1。


科目:高中化学 来源: 题型:
下列有关原电池的说法中正确的是( )
A.在内电路中,电子由正极流向负极
B.在原电池中,相对较活泼的金属作负极,不活泼的金属作正极
C.原电池工作时,正极表面一定有气泡产生
D.原电池工作时,可能会伴随着热能变化
查看答案和解析>>
科目:高中化学 来源: 题型:
利用反应6NO2+8NH3===7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
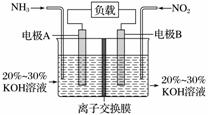
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电极A极反应式为2NH3-6e-===N2+6H+
D.当有4.48 L NO2(标准状况)被处理时,转移电子为0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
生活和生产中常用到胶体的性质,请看下述四例:
(1)做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是________________________________________________________________________
______________________________________________________________________。
(2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径在10-9~10-7m之间,然后插入两根电极,再接通直流电源。这时阳极聚集陶土胶粒,阴极聚集氧化铁胶粒,理由是________。
(3)水泥和冶金工厂常用高压电对气溶胶作用以除去大量烟尘,减少对空气的污染,这种作用运用了________原理。
(4)四氧化三铁在强碱性溶液中与次氯酸盐反应,生成高铁酸盐(FeO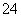 ),FeO
),FeO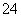 有强氧化性,可以杀菌消毒。高铁酸盐还有净化水的作用,能净化水的原因是 ________________________________________________________________________
有强氧化性,可以杀菌消毒。高铁酸盐还有净化水的作用,能净化水的原因是 ________________________________________________________________________
_________________________________________________________________ ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度( )
(2)不可能使要除去的离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时,沉淀已经完全( )
(3)在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀( )
(4)常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小( )
(5)溶度积常数Ksp只受温度影响,温度升高Ksp增大( )
(6)常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变( )
查看答案和解析>>
科目:高中化学 来源: 题型:
实验:①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS在一定条件下可转化为CuS
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp越小的电解质,其溶解度一定越小
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为___________________________。
(3)实验①和②的目的是___________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:
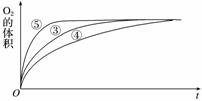
分析上图能够得出的实验结论是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com