
下列元素性质的递变规律正确的是( )
A.原子半径:Be<B<C<N
B.第一电离能:B<Be<Mg<Na
C.元素的电负性:O>N>S>P
D.气态氢化物的稳定性:NH3<CH4<PH3<SiH4
科目:高中化学 来源: 题型:
某氖原子的质量为a g,一个12C原子质量为b g,NA表示阿伏加德罗常数,则下列说法中正确的是( )
A.氖元素的相对原子质量一定是12a/b
B.W g该氖原子的物质的量一定是W/(aNA)mol
C.该氖原子的摩尔质量是aNA g
D.W g该氖原子所含的质子数是10 W/(aNA)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,哪些违反了泡利原理________,哪些违反了洪特规则________。

(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________;其最高价氧化物对应水化物的化学式是________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙烯可以催熟果实,为了延长果实的寿命,便于长距离运输,人们在装有果实的密闭容器内放入浸泡过某种溶液的硅藻土,用来吸收果实产生的乙烯。该溶液最可能是( )
A.NaCl溶液 B.NaOH溶液
C.溴水 D.KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是 ( )。
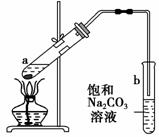
A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
用洁净的铂丝蘸取某种无色溶液,在无色火焰上灼烧,火焰呈黄色,说明该溶液中( )
A.只有Na+ B.可能有Na+,可能有K+
C.一定有K+ D.一定有Na+,也可能有K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com