
| A、向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
| B、工业上制取单质硅 |
| C、Na2O2作呼吸面具中的供氧剂 |
| D、一定条件下用硫酸铜制Cu |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
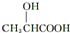 )有关的化学方程式:
)有关的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:
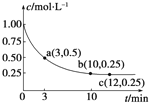 已知可逆反应X(g)+2Y(g)?Z(g)△H<0,一定温度下,在体积为2L的密闭容器中加入4mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )
已知可逆反应X(g)+2Y(g)?Z(g)△H<0,一定温度下,在体积为2L的密闭容器中加入4mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )| A、a点正反应速率大于逆反应速率 |
| B、增大X的浓度,X的转化率增大 |
| C、容器中压强恒定时,不能说明反应已达平衡状态 |
| D、保持温度和密闭容器的压强不变,再充入1 mol X和2 mol Y,再次达到平衡时n(Z)/n(X)的值会变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体密度不再发生变化 |
| B、容器内各物质的浓度不再发生变化 |
| C、正反应和逆反应都已停止 |
| D、单位时间消耗0.1mol N2的同时生成0.2mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选 项 | 实验操作及现象 | 实验目的或结论 |
| A | 将硫酸酸化的H202溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H202比Fe3+强 |
| B | 在0.1mol?L-1的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 | 验证盐类水解反应是吸热反应 |
| C | 将一定量的NaNO3和KCl的混合液加热并浓缩至有晶体析出时,趁热过滤 | 得到NaCl晶体 |
| D | 苯酚钠溶液中通入足量二氧化碳产生浑浊 | 苯酚的酸性弱于碳酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X为非金属性最强的元素 |
| B、Y 的最高价氧化物对应水化物为强碱 |
| C、Z与氢元素形成的化合物只有一种 |
| D、Y2Z为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
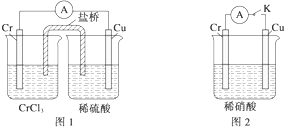
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com