
(16分)I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题:
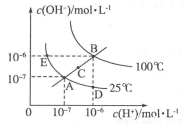
(1)图中A、B、C、D四点的 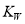 由大到小的顺序:______。
由大到小的顺序:______。
(2)若从A点到D点,可采用的方法是________________________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为____。
Ⅱ.(1)室温下,向氨水中加入稀盐酸,使其恰好完全中和,所得溶液的pH_______7(填“>”、“<”或“=”),用离子方程式表示其原因________________________,所得溶液中各离子物质的量浓度由大到小的顺序为____________;
(2)氨水中加入少量氯化铵固体,NH3.H2O的电离平衡_______(“向左”、“向右”或“不”)移动,此时溶液中 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
Ⅰ(1)B>C>A=D(2)加入酸或加入水解显酸性的盐(3)100:1。Ⅱ(1)<NH4++H2O NH3H2O+H+c(Cl-)>c(NH4+)>c(H+)>c(OH-)。(2)向左减小。
NH3H2O+H+c(Cl-)>c(NH4+)>c(H+)>c(OH-)。(2)向左减小。
【解析】
试题分析:Ⅰ(1)因为平衡常数只受温度影响,温度升高,平衡正向移动,平衡常数变大,所以有B>C>A=D。(2)溶液由中性变成酸性,所以可以加入酸或加入水解显酸性的盐。(3)100℃时,将pH=2的硫酸的氢离子浓度为10-2mol/L,由于100℃时水的离子积常数为10-12,所以pH=12的KOH溶液中氢氧根离子浓度为1mol/L,假设二者的体积分别为a升和b升,混合至呈中性,则有10-2×a=1×b解a/b=100:1。Ⅱ(1)由于恰好完全反应生成氯化铵,属于强酸弱碱,铵根离子水解使溶液显酸性,所以pH<7。离子方程式为:NH4++H2O NH3H2O+H+;氯化铵电离出等量的氯离子和铵根离子,由于铵根离子水解,所以氯离子浓度大于铵根离子浓度,溶液显酸性,所以氢离子浓度大于氢氧根离子浓度,所以离子浓度顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)。(2)氨水中加入少量氯化铵固体,铵根离子浓度增大,平衡向左移动,氢氧根离子浓度减小,一水合氨浓度增大,所以溶液中氢氧根浓度比一水合氨浓度的数值减小。
NH3H2O+H+;氯化铵电离出等量的氯离子和铵根离子,由于铵根离子水解,所以氯离子浓度大于铵根离子浓度,溶液显酸性,所以氢离子浓度大于氢氧根离子浓度,所以离子浓度顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)。(2)氨水中加入少量氯化铵固体,铵根离子浓度增大,平衡向左移动,氢氧根离子浓度减小,一水合氨浓度增大,所以溶液中氢氧根浓度比一水合氨浓度的数值减小。
考点:酸碱混合后溶液的相关计算,盐类的水解。


科目:高中化学 来源:2014-2015四川省广安市高一期末考试化学试卷(解析版) 题型:选择题
在200mL氯化铁和氯化铝的混合液中,Fe3+的物质的量浓度为0.2mol/L,Cl-的物质的量浓度为1.8 mol/L。要使Fe3+全部转化为沉淀分离出来,至少需要加入 4 mol/L NaOH溶液的体积为
A.30mL B.110mL C.90mL D.180mL
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省聊城市茌平等三县高二上学期期末联考化学试卷(解析版) 题型:选择题
反应 在四种不同情况下的反应速率分别为
在四种不同情况下的反应速率分别为 
 该反应进行的快慢顺序为
该反应进行的快慢顺序为
A.④>③=②>① B.④<③=②<①
C.①>②>③>④ D.④>③>②>①
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省菏泽市高一上学期期末考试化学A试卷(解析版) 题型:选择题
下列叙述正确的是
A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同
C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.过量的铜与浓硝酸反应,生成的气体只有NO2
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省菏泽市高一上学期期末考试化学A试卷(解析版) 题型:选择题
下列叙述中,正确的是
A.NaCl溶于水在电流作用下电离成Na+ 和Cl-
B.CaCO3在水中溶解度很小,但溶于水的CaCO3全部电离,所以CaCO3是强电解质
C.某元素在化学反应中由化合态变为游离态(单质),则该元素一定被氧化
D.化合反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
汽车尾气净化中的一个反应如下:
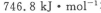 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
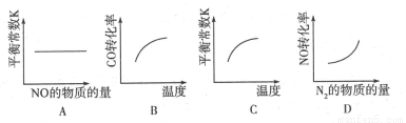
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.明矾水解形成的Al(0H)3胶体能杀菌消毒,可用于水的净化
B.镀锡的铁制品比镀锌的铁制品耐用
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HC1和CH3COOH恰好中和时,消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高一上学期期末化学试卷(解析版) 题型:选择题
下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3 ,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀 |
B | CO2通入BaCl2溶液中 | 有白色沉淀出现 | 生成了BaCO3沉淀 |
C | Al箔插入稀 | 无现象 | Al箔表面被 |
D | 用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上 | 试纸先变红色后褪色 | 浓硝酸有酸性和氧化性 |
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列有关化学键与晶体说法中,不正确的是
A.离子晶体的晶格能越大,离子晶体的密度就越大
B.共价键的键能越大,分子晶体的熔、沸点越高
C.成键原子的原子轨道重叠越多,共价键越牢固
D.共用电子对不发生偏移的化学键是非极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com