
【题目】某温度下,将3mol A和2mol B充入一密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g),
C(g)+D(g),
5 min后达平衡,各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情
况下将容器的体积扩大为原来的10倍,B的转化率不发生变化,则B的转化率为( )
A. 60% B.40% C.24% D.4%
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验的做法正确的是 ( )
A. 用pH试纸测氯水的pH
B. 用托盘天平准确称取5.72 g NaCl晶体
C. 用酸式滴定管量取20.00 mL的酸性KMnO,溶液
D. 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断正确的是( )
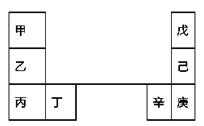
A. 乙的单质在空气中燃烧生成只含离子键的化合物
B. 原子半径:庚>辛>戊
C. 金属性:甲>乙>丁
D. 丙和庚的原子核外电子数相差13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
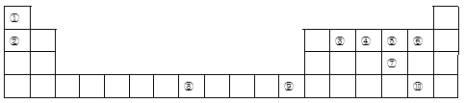
(1)比较①和②具有相同核外电子排布的简单离子半径大小关系为______________(填化学式);③、④、⑤三种元素的第一电离能由大到小的顺序为____________(填元素符号),写出原子序数和元素⑧相差2且元素⑧同族的元素基态原子的外围电子排布式____________。
(2)在元素③与①形成的原子个数比为1:1的四原子分子中,③原子的杂化方式为____________。其分子中δ键和π键数目之比为____________。
(3)元素④的某种氢化物甲分子中含有18个电子,甲为二元弱碱,在水中的电离方程式与氨相似。写出甲在水中的第一步电离的电离方程式____________。甲在微电子工业中,可作刻蚀剂H2O2的清除剂,二者发生反应的产物不污染环境,其化学方程式为____________。
(4)元素⑥和⑤形成分子乙的结构与元素①和⑤形成的最简单分子丙相似,乙的VSEPR模型为___________,解释丙的沸点高于乙的原因____________。
(5)可用赤血盐K3[Fe(CN)6]检验元素⑧的+2价阳离子,写出该反应的离子方程式___________,元素⑩的阴离子与元素⑧的+2价离子形成化合物丁,将3molCl2通入含4mol丁的溶液,用一个离子方程式表示该反应过程为____________。
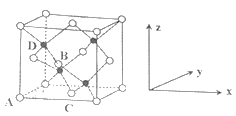
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为⑦和⑨组成的离子化合物戊的晶胞,其中三个离子(白色球)坐标参数A为(0,0,0);B为(,0,);C为(,,0)。则D离子(黑色球)的坐标参数为_____。
②晶胞参数,描述晶胞的大小和形状,已知戊的晶胞参数apm,则晶胞中B和D离子的距离为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中化合物的性质比较,不正确的是( )
A. 酸性:HClO4>HBrO4>HIO4
B. 稳定性:PH3>H2S> HCl
C. 碱性:NaOH>Mg(OH)2>Al(OH)3
D. 非金属性F>O>S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷、乙烯、乙醇、乙酸的说法中,不正确的是( )
A.乙烯可以使溴水褪色,发生加成反应
B.甲烷和氯气光照条件下反应,反应类型为取代反应
C.乙醇与金属钠的反应比较激烈
D.生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com