
| A、上述反应属于置换反应 | B、当有1mol CuI反应时,转移电子为0.5mol | C、该反应中的氧化剂为CuI | D、Cu2HgI4既是氧化产物又是还原产物 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、1.0L 1mol/L的NaNO3溶液中含有的氧原子数为3NA | B、30g SiO2晶体中含有Si-O键数目为2NA | C、25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA | D、1mol羟基与1molOH-离子所含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Fe与足量Cl2反应,转移的电子数为2NA | B、标准状况下,22.4L乙烷中含有的共价键数目为8NA | C、标准状况下,lmol SO3含有的氧原子数为3NA | D、pH=1的稀硫酸中含有的H+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Al3+含有的核外电子数为3NA | B、将58.5g NaCl溶于1.00L水中,所得NaCl溶液的浓度为1.00mol?L-1 | C、1mol Cl2与足量的铁反应,转移的电子数为3NA | D、常温下,10L pH=1的硫酸溶液中含有的H+离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol甲基中含有 7NA个电子 | B、31 g白磷中含有NA个P-P键 | C、标态下,22.4L臭氧中含有NA个氧原子 | D、10.6 g Na2CO3固体中含0.1 NA个CO32-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.5% | B、25% | C、50% | D、75% |
查看答案和解析>>
科目:高中化学 来源: 题型:
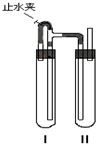 由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法.甲同学:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等制备.
由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法.甲同学:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等制备.查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | (35±15)mg?kg-1(以I计) |
| 使用方法 | 勿长时间炖炒,食品熟后加入 |
| A、此食盐是纯净物 |
| B、“勿长时间炖炒”的原因可能是碘酸钾受热不稳定 |
| C、仅用淀粉溶液就可以检验此食盐中是否含碘 |
| D、1kg此食盐中含碘酸钾(35±15)mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成盐和水的反应一定是中和反应 | B、汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分 | C、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | D、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com