
| A. | 500 mL 1 mol/L的HNO3溶液 | B. | 1 L 0.5 mol/L的Fe(NO3)3溶液 | ||
| C. | 100 mL 0.5 mol/L的Mg(NO3)2溶液 | D. | 300 mL 1 mol/L的Mg(NO3)2溶液 |
分析 硝酸根离子的物质的量浓度与溶质的浓度及其化学式组成有关,与溶液的体积大小无关,据此对各选项进行计算和判断.
解答 解:A.500mL 1mol/L的HNO3溶液中含有硝酸根离子的浓度为1mol/L;
B.1L 0.5mol/L的Fe(NO3)3溶液中NO3-的物质的量浓度为:0.5mol/L×3=1.5mol/L;
C.100 mL 0.5 mol/L的Mg(NO3)2溶液中NO3-的物质的量浓度为:0.5mol/L×2=1mol/L;
D.300mL 1 mol/L的Mg(NO3)2溶液中NO3-的物质的量浓度为:1mol/L×2=2mol/L;
根据分析可知,溶液中NO3-的物质的量浓度最大的是D,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意粒子的物质的量浓度与溶液的体积大小无关,为易错点.


科目:高中化学 来源: 题型:解答题
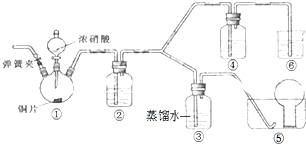 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烷烃,含有3个甲基结构的同分异构体有2种 | |
| B. | 丙烯能发生加成反应,还能使酸性KMnO4溶液褪色 | |
| C. | 甲苯中所有原子都处于同一平面 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
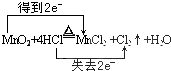 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com