
分析 (1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性减弱、非金属性增强,故1~20号元素中,非金属性最强为F,属于稀有气体的是He、Ne、Ar,金属性最强的为F;
(2)反应2NO2 (g) (红棕色)?N2O4(g) (无色),正反应是放热反应;所以将装有NO2 和N2O4混合气体的烧瓶浸入热水中,平衡逆向移动;
(3)①4.48L混合气体的物质的量为:0.2mol,所以氮气的物质的量浓度为:0.025mol/L,浓度变化量为:0.005mol/L,所以v(N2)=$\frac{0.005mol/L}{3min}$,根据速率之比等于对应物质的化学计量数之比,求v (NH3);
②达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变.
解答 解:(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性减弱、非金属性增强,故1~20号元素中,非金属性最强为F,属于稀有气体的是He、Ne、Ar,金属性最强的为F,在元素周期表中的位置为:第二周期第ⅦA族,
故答案为:K; He、Ne、Ar; 第二周期第ⅦA族;
(2)反应2NO2 (g) (红棕色)?N2O4(g) (无色),正反应是放热反应;所以将装有NO2 和N2O4混合气体的烧瓶浸入热水中,平衡逆向移动,所以气体颜色加深或红棕色加深,
故答案为:气体颜色加深或红棕色加深;存在平衡2NO2?N2O4,加热,平衡发生逆向移动,NO2浓度增大,颜色变深;
(3)①4.48L混合气体的物质的量为:0.2mol,所以氮气的物质的量浓度为:0.025mol/L,浓度变化量为:0.005mol/L,所以v(N2)=$\frac{0.005mol/L}{3min}$,根据速率之比等于对应物质的化学计量数之比,v (NH3)=0.003 mol•L-1•min-1,
故答案为:0.003 mol•L-1•min-1;
②a.v(H2)=3v(N2),未体现正与逆的关系,故错误;
b.容器内压强保持不变,说明气体的总物质的量不变,反应达平衡状态,故正确;
c.每消耗1mol N2,同时生成2mol NH3,都反映正反应的方向,未体现正与逆的关系,故错误;
d.N2、H2和NH3的物质的量浓度不再变化,说明正逆反应速率相等,达平衡状态,故正确;
故选:b、d.
点评 本题考查了反应速率的计算、化学平衡状态的判断、平衡的移动,题目难度不大,明确化学平衡状态的特征为解答关键,试题有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl- | |
| B. | AlCl3溶液呈酸性:Al3++3H2O→Al(OH)3+3H+ | |
| C. | Al2(SO4)3溶液加入过量的氨水:Al3++3 NH3•H2O→Al(OH)3↓+3NH4+ | |
| D. | NaOH溶液中滴加少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
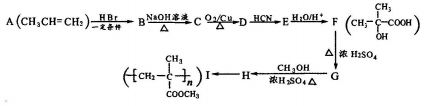
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
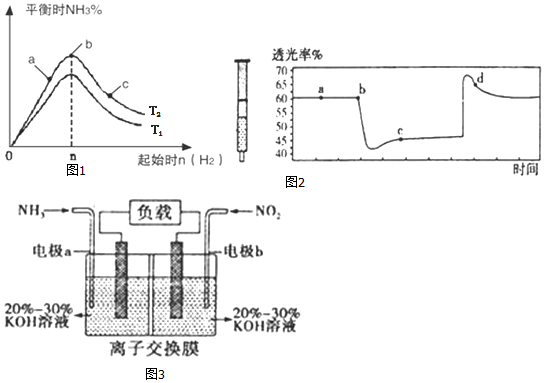
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24gNaH中阴离子所含电子总数为2NA | |
| B. | 标准状况下,44.8LNO与22.4LO2混合后,气体中分子总数为2NA | |
| C. | 在0.lmol/L的K2CO3溶液中,阴离子数目大于O.1NA | |
| D. | 300mL2mol/L乙醇溶液中所含分子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,30g丙醇中存在的共价键总数为5NA | |
| C. | 2 mol Cu和足量热浓硫酸反应可生成2NA个SO3分子 | |
| D. | 电解法精炼铜时,若转移的电子数为NA个,则阳极质量减小32g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
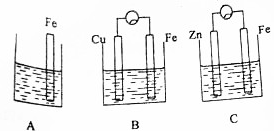 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
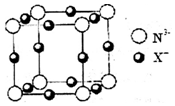 氮是重要的非金属元素,可以形成多种化合物.回答以下问题:
氮是重要的非金属元素,可以形成多种化合物.回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com