
| A、①②⑤ | B、②③④ |
| C、①②⑥ | D、②③⑤ |


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
 如图:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
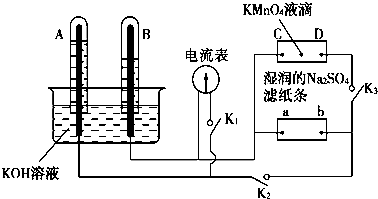
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L苯中约含有个NA碳原子 |
| B、标准状况下,22.4L H2中含中子数为2NA |
| C、1L 1mol/L醋酸溶液中离子总数为2NA |
| D、1mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4、C2H4 |
| B、CH3CH2OH、CH3COOH |
| C、C2H6、HCHO |
| D、HCOOH、CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
| A、上述反应是熵增反应 |
| B、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol?L-1,则此时反应逆向进行 |
| C、25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 |
| D、恒温恒容,向达平衡的容器中再充入少量Ni(CO)4(g),达新平衡时,CO的百分含量将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO-3═4Mg2++NH4++3H2O |
| B、将10mL 0.1mol/L Na2CO3溶液逐滴滴加到10mL 0.1mol/L盐酸中,c(Na+)>c(Cl-)>c(HCO-3)>c(CO32-) |
| C、等PH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH+4)=c(K+)=2c(Ba2+) |
| D、将10mL 0.1mol?L-1 KAl(SO4)2溶液和10mL 0.2mol?L-1 Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com