
 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
 Al2O3+2Fe
Al2O3+2Fe 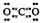 (3) 2Fe3++Cu=2Fe2++Cu2+
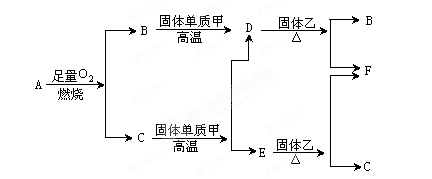
(3) 2Fe3++Cu=2Fe2++Cu2+  2F+D,F中的E元素的质量分数为60%可知,E是镁,F是氧化镁,D是碳,因此A是氧气。G是一种红棕色粉末,所以G是氧化铁。C既能与盐酸又能与NaOH溶液反应,且C是单质,所以C是铝,则H是氧化铝。
2F+D,F中的E元素的质量分数为60%可知,E是镁,F是氧化镁,D是碳,因此A是氧气。G是一种红棕色粉末,所以G是氧化铁。C既能与盐酸又能与NaOH溶液反应,且C是单质,所以C是铝,则H是氧化铝。 Al2O3+2Fe;引发铝热反应的正确操作是在混合物上面加少量氯酸钾,中间插一根打磨过的镁条,点燃镁条。
Al2O3+2Fe;引发铝热反应的正确操作是在混合物上面加少量氯酸钾,中间插一根打磨过的镁条,点燃镁条。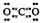 。
。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:H2SO4>HClO4>HBrO4 | B.半径:Li+<Mg2+<Al3+<O2- |
| C.非金属性: P>S>Cl | D.气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com