
A、
| ||
B、
| ||
C、
| ||
D、
|
| m |
| M |
| n |
| V |
| wg |
| 96g/mol |
| w |
| 96 |
| 2 |
| 3 |
| 2w |
| 288 |
| 2w |
| 288 |
| 1 |
| 2 |
| w |
| 288 |
| ||
| 2V×10-3L |
| 125w |
| 72V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
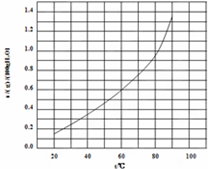
| A、溴酸银的溶解是放热过程 |
| B、温度升高时溴酸银溶解速度加快 |
| C、60℃时溴酸银的KSP约等于6.25×10-4 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、2H既可表示2个氢原子又可表示2 mol氢分子 |
| C、1mol氧含6.02×1023个O2 |
| D、摩尔是物质的量的单位,简称摩,符号为mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| B、在铁粉中加入硫酸铁溶液:Fe3++Fe=2Fe2+ |
| C、氧化铜溶于稀硝酸:CuO+2H+=Cu2++H2O |
| D、小苏打与氢氧化钠两种溶液混合:HCO3-+OH-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3 溶液中投入过量Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ |
| B、苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- |
| C、硫化钠的水解反应:S2-+H2O?HS-+OH- |
| D、NaClO 溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HS03- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4LCO2中含有NA个CO2分子 |
| B、1.7 gH2O2中含有电子数为0.9NA |
| C、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| D、分子总数为NA的CO和C2H4混合气体体积约为22.4L则质量为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com