
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.
已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol﹣1,
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534kJ•mol﹣1.
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式: .
(2)已知:N≡N的键能是946kJ•mol﹣1,H﹣H的键能为436kJ•mol﹣1,N﹣H的键能为393kJ•mol﹣1,计算合成氨反应生成1molNH3的△H= kJ•mol﹣1.
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为
②加水稀释100倍,所得溶液中由水电离出c(OH﹣)=
③与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11,该盐酸溶液的pH= .
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO﹣)(填“>”或“=”或“<”).
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO﹣).
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积.
考点:
用盖斯定律进行有关反应热的计算;有关反应热的计算;pH的简单计算;酸碱混合时的定性判断及有关ph的计算.
专题:
化学反应中的能量变化;电离平衡与溶液的pH专题.
分析:
(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数作相应的加减.
(2)根据反应热△H=反应物的总键能﹣生成物的总键能,计算合成氨反应N2+3H2 2NH3的反应热△H,进而计算生成1molNH3的反应热.
2NH3的反应热△H,进而计算生成1molNH3的反应热.
(3)现有25℃、pH=13的Ba(OH)2溶液中c(OH﹣)=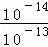 mol/L=0.1mol/L.
mol/L=0.1mol/L.
①Ba(OH)2溶液的物质的量浓度为是氢氧根离子浓度的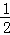 .
.
②加水稀释100倍,溶液中c′(OH﹣)=0.1mol/L×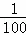 =0.001mol/L,溶液中氢离子是水电离产生的,水电离生成的氢离子浓度等于水电离生成氢氧根离子浓度,根据Kw=c(H+)•c(OH﹣)计算溶液中c(H+).
=0.001mol/L,溶液中氢离子是水电离产生的,水电离生成的氢离子浓度等于水电离生成氢氧根离子浓度,根据Kw=c(H+)•c(OH﹣)计算溶液中c(H+).
③与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11,溶液呈碱性,溶液中c(OH﹣)=1×10﹣3 mol/L,令盐酸的浓度为xmol/L,盐酸的体积为9L,氢氧化钠的体积为1L,用x表示出反应后氢氧根离子的浓度,列方程计算x的值,再根据PH=﹣logc(H+)计算盐酸的PH值.
(4)、①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好反应,溶液中溶质为醋酸钠,醋酸钠是强碱弱酸盐,醋酸根水解使溶液呈碱性.
②醋酸是弱电解质,电离程度不大,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液,醋酸大量剩余,醋酸的电离程度大于醋酸根的水解,溶液呈酸性;
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,根据电荷守恒可知氢离子与氢氧根离子的浓度相等,溶液呈中性;溶液中存在醋酸根的水解,由物料守恒可知原醋酸溶液中醋酸的物质的量大于氢氧化钠的物质的量.
解答:
解:(1)已知:①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol﹣1,
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534kJ•mol﹣1.
由盖斯定律,②×2﹣①得2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=(﹣534kJ•mol﹣1)×2﹣67.7kJ•mol﹣1=﹣1135.7kJ•mol﹣1.
故答案为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=﹣1135.7kJ•mol﹣1.
(2))已知:N≡N的键能是946kJ•mol﹣1,H﹣H的键能为436kJ•mol﹣1,N﹣H的键能为393kJ•mol﹣1,故合成氨反应N2+3H2 2NH3的反应热△H=946kJ•mol﹣1×2+3×436kJ•mol﹣1﹣6×393kJ•mol﹣1=﹣104kJ•mol﹣1,故生成1molNH3的△H=﹣104kJ•mol﹣1×
2NH3的反应热△H=946kJ•mol﹣1×2+3×436kJ•mol﹣1﹣6×393kJ•mol﹣1=﹣104kJ•mol﹣1,故生成1molNH3的△H=﹣104kJ•mol﹣1×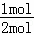 =﹣52kJ•mol﹣1.
=﹣52kJ•mol﹣1.
故答案为:﹣52kJ•mol﹣1.
(3)现有25℃、pH=13的Ba(OH)2溶液中c(OH﹣)=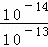 mol/L=0.1mol/L.
mol/L=0.1mol/L.
①Ba(OH)2溶液的物质的量浓度为是氢氧根离子浓度的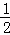 ,故氢氧化钡的浓度为0.1mol/L×
,故氢氧化钡的浓度为0.1mol/L×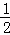 =0.05mol/L.
=0.05mol/L.
故答案为:0.05mol/L.
②加水稀释100倍,溶液中c′(OH﹣)=0.1mol/L×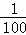 =0.001mol/L,溶液中氢离子是水电离产生的,水电离生成的氢离子浓度等于水电离生成氢氧根离子浓度,溶液中c(H+)=
=0.001mol/L,溶液中氢离子是水电离产生的,水电离生成的氢离子浓度等于水电离生成氢氧根离子浓度,溶液中c(H+)=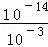 mol/L=1×10﹣11mol/L,故所得溶液中由水电离出c(OH﹣)=1×10﹣11mol/L.
mol/L=1×10﹣11mol/L,故所得溶液中由水电离出c(OH﹣)=1×10﹣11mol/L.
故答案为:1×10﹣11mol/L.
③与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11,溶液呈碱性,溶液中c(OH﹣)=1×10﹣3 mol/L,令盐酸的浓度为xmol/L,盐酸的体积为9L,氢氧化钠的体积为1L,则1L×0.1mol/L﹣9L×xmol/L=(9L+1L)×1×10﹣3 mol/L,解得x=0.01,故盐酸的PH=﹣logc(H+)=﹣log0.01=2.
故答案为:2.
(4)、①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好反应,溶液中溶质为醋酸钠,醋酸钠是强碱弱酸盐,醋酸根水解使溶液呈碱性,溶液中c(Na+)>c(CH3COO﹣).
故答案为:碱性;>.
②醋酸是弱电解质,电离程度不大,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液,醋酸大量剩余,醋酸的电离程度大于醋酸根的水解,溶液呈酸性,溶液中c(Na+)<c(CH3COO﹣).
故答案为:酸性;<.
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,根据电荷守恒可知氢离子与氢氧根离子的浓度相等,溶液呈中性;溶液中存在醋酸根的水解,由物料守恒可知原醋酸溶液中醋酸的物质的量大于氢氧化钠的物质的量,故醋酸体积>氢氧化钠溶液体积.
故答案为:中性;>.
点评:
考查利用盖斯定律书写热化学方程式、反应热的计算、溶液PH值的有关计算、盐类水解、离子浓度比较等,综合性较大,难度中等,是对知识的综合运用,注意基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E。
③工业上以A、空气和水为原料,通过催化氧化法制成E。
请回答以下问题:
(1)A分子的立体构型是 ;从轨道重叠的方式看,B分子中的共价
键类型有________________________________________________________。
(2)写出②中反应的化学方程式_________________________________。
(3)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,
同时有B生成,写出有关反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物,A的单质常温下为密度最小的气体;B与Z的最外层电子数之比为2:3,常见化合物Y2X2是淡黄色固体,能与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Y的原子结构示意图为; Z在周期表中的位置是;B元素的名称为碳.
(2)化合物Y2X2属于A(填序号).
A.离子化合物 B.共价化合物
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为.
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入(填物质名称);放电时KOH溶液中的OH﹣往负极方向移动(填正或负).
(5)1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为了有效发展民用氢能源,首先必须制得廉价的氢气.下列可供开发、较经济又具有广阔前景的制氢方法是(填写编号)
①光解海水 ②锌和稀硫酸反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
当下列各组物质的总物质的量不变时,使各组分以任意比混合后充分燃烧,消耗氧气的量和生成CO2的物质的量不变的是( )
|
| A. | 乙烯、乙醇、乙醛 | B. | 乙炔、乙醛、乙二醇 |
|
| C. | 甲烷、甲醇、乙酸 | D. | 甲烷、甲酸甲酯、丙二酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )
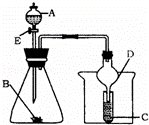
|
| A. | 若A为醋酸,B为贝壳(粉状),C为盛苯酚钠溶液,则C中溶液变浑浊 |
|
| B. | 若A为食盐水,B为电石,C中盛KMnO4溶液,则C中溶液褪色 |
|
| C. | 若A为浓氨水,B为生石灰,C中盛AgNO3溶液,则C中无现象 |
|
| D. | 实验中仪器D可起到防倒吸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是()
A. 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
B. 等物质的量浓度的醋酸与醋酸钠溶液中水电离产生的c(OH﹣).前者小于后者
C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变
D. 水的离子积只与温度有关,向水中加入酸、碱或盐一定会影响水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)⇌CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与 压强的关系如右下图所示.下列说法正确的是()
压强的关系如右下图所示.下列说法正确的是()
A.温度: T1>T2>T3
B.正反应速率: υ(b)>υ(d) υ(a)>υ(c)
C.平衡常数: K(a)>K(c) K(b)=K(d)
D.平均摩尔质量: M(b)>M(d) M(a)<M(c)
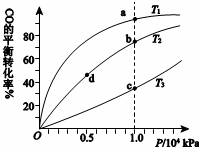
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是()
A. 26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA
B. 1mol甲基(﹣CH3)所含电子数为9NA
C. 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA
D. 标准状况下,1L庚烷所含有的分子数为NA/22.4
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示实验装置用于测定气体摩尔体积,相关叙述正确的是 ( )。
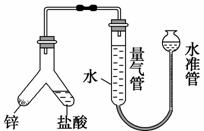
A.用CCl4代替水,测得氢气的体积更准确
B.量气管压入漏斗的水过多而溢出,会导致测定失败
C.必须待体系温度降低到0 ℃时才可进行读数
D.上提水准管,量气管液面高度不断改变,说明装置漏气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com