
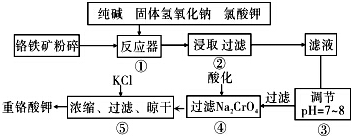
分析 流程分析可知,铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2、Al2O3)为原料粉碎后再反应器中加入纯碱、固体氢氧化钠、氯酸钾浸取过滤得到滤液调节溶液PH除去铝和硅酸根离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾;
(1)依据影响化学反应速率的因素分析,增大接触面积会加快反应速率;
(2)根据水解平衡移动判断产物;
(3)在酸性环境下,CrO42-转化为Cr2O72-,据此来书写方程式;
(4)操作⑤加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大;
(5)根据Ksp(FeS)=c(Fe2+)•c(S2-)结合(Fe2+)为 lmol/L,可计算出硫离子的浓度,再根据c2 (H+)•c(S2-)=1.0×10-22,计算出氢离子的浓度.
解答 解:(1)碱浸前将铭铁矿粉碎的作用是增大接触面积加快反应速率,
故答案为:增大接触面积,增大反应速率;
(2)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:H2SiO3、Al(OH)3;
(3)在酸性环境下,CrO42-转化为Cr2O72-,即2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
(4)操作⑤加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应,可得到重铬酸钾;
故答案为:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应,可得到重铬酸钾;
(5)根据Ksp(FeS)=c(Fe2+)•c(S2-)=6.25×10 -18,结合(Fe2+)为 lmol/L,可知c(S2-)=6.25×10 -18 mol/L,根据c2(H+)•c(S2-)=1.0×10-22,得c(H+)=$\sqrt{\frac{1.0×10{\;}^{-22}}{6.25×10{\;}^{-18}}}$mol/L=4×10 -3mol/L,
故答案为:4×10 -3mol/L.
点评 本题考查较为综合,涉及氧化还原反应、溶解平衡以及滴定操作等问题,题目难度中等,本题注意从质量守恒的角度利用关系式法计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>X | |
| B. | 元素X与M形成的化合物的空间构型可能是正四面体、直线型或平面型 | |
| C. | 将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种 | |
| D. | 由Z、M两种种元素形成的化合物一定只有极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属活动性:A>B | |
| B. | A极是正极,电解质溶液可以是盐酸 | |
| C. | B极是负极 | |
| D. | 要判断A极与B极是正极还是负极,还需考虑电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
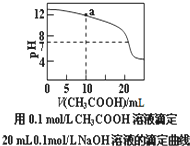
| A. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| B. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| C. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 图中pH=7时c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 k Pa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热 量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在10l k Pa时l mol H2完全燃烧生成液态水放出285.8 kJ热量,H2燃烧热为-285.8kJ/mol | |
| C. | 鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com