A、B、C、D、E、F为原子序数依次增大的六种元素,其中除F外均为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E、F的单质均为固体,且F单质是目前世界上使用量最大的金属.A是所有元素中原子半径最小的元素,C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个.请用化学用语回答下列问题:
(1)C的离子结构示意图为
;D与E两元素的离子半径:D
<
<
E(填“>”、“<”或“=”).
(2)由A与碳元素组成的原子个数比3:1的最简化合物的结构简式为
CH3-CH3
CH3-CH3
.
(3)A与C形成的10电子阴离子与A与E形成的18电子阴离子反应的离子方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
.
(4)B的最高价氧化物的水化物与其氢化物反应生成的盐的水溶液的PH
<
<
7(填“>”、“<”或“=”).化合物AB
3是一种无色的液态物质,受撞击会分解成两种单质,请写出该反应的化学方程式
2HN3=H2↑+3N2↑
2HN3=H2↑+3N2↑
.
(5)已知一定条件下,D单质与氧化物F
3O
4反应时,放出大量的热且使F单质熔化.试写出该反应的化学方程式
.
(6)上述元素中的五种元素可形成一种复盐,三种离子个数比为1:1:2,若向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出;若加入盐酸酸化的BaCl
2溶液,也有白色沉淀产生.则该复盐的化学式为
NH4Al(SO4)2
NH4Al(SO4)2
.

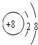
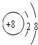
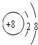 .微粒半径大小比较看电子层数,电子层数越多,半径越大,D离子是Al3+与E离子是S2-,Al3+离子结构示意图为
.微粒半径大小比较看电子层数,电子层数越多,半径越大,D离子是Al3+与E离子是S2-,Al3+离子结构示意图为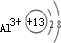 ,S2-离子结构示意图为
,S2-离子结构示意图为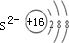 ,Al3+核外2个电子层,S2-核外3个电子层,故离子半径:Al3+<S2-,
,Al3+核外2个电子层,S2-核外3个电子层,故离子半径:Al3+<S2-,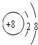 ;<;
;<;

 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.