
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
|
| A. | 甲的分子数比乙的分子数多 |
|
| B. | 甲的物质的量比乙的物质的量少 |
|
| C. | 甲的摩尔体积比乙的摩尔体积小 |
|
| D. | 甲的相对分子质量比乙的相对分子质量小 |
考点:
阿伏加德罗定律及推论.
专题:
阿伏加德罗常数和阿伏加德罗定律.
分析:
两容器的温度和压强均相同,则气体的Vm相等,两容器气体质量相等,且甲的密度大于乙的密度,可知甲体积小于于乙体积,由n= 可知甲气体的物质的量小于乙,以此解答该题.
可知甲气体的物质的量小于乙,以此解答该题.
解答:
解:两容器的温度和压强均相同,则气体的Vm相等,两容器气体质量相等,且甲的密度大于乙的密度,可知甲体积小于乙体积,由n= 可知甲气体的物质的量小于乙,
可知甲气体的物质的量小于乙,
A.由以上分析可知甲气体的物质的量小于乙,则甲的分子数小于乙的分子数,故A错误;
B.由以上分析可知甲气体的物质的量小于乙,故B正确;
C.两容器的温度和压强均相同,则气体的Vm相等,故C错误;
D.气体质量相同,甲的物质的量比乙的物质的量小,由M= 可知甲的相对分子质量大于乙的相对分子质量,故D错误.
可知甲的相对分子质量大于乙的相对分子质量,故D错误.
故选B.
点评:
本题考查阿伏伽德罗定律及其推论,题目难度不大,注意相关物理量计算公式的运用,理解概念,把握公式是解答该类题目的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是()
①标准状况下,6.02×1023个分子所占的体积约是22.4L
②0.5mol H2所占体积为11.2L
③标准状况下,1mol H2O的体积为22.4L
④常温常压下,28g CO与N2的混合气体所含的原子数为2NA
⑤各种气体的气体摩尔体积都约为22.4L•mol﹣1
⑥标准状况下,体积相同的气体的分子数相同.
A. ①③⑤ B. ④⑥ C. ③④⑥ D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是关于反应A2(g)+3B2(g)⇌2C(g)△H<0的平衡移动图形,影响平衡移动的原因是()
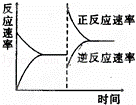
A. 升高温度,同时加压
B. 降低温度,同时减压
C. 增大反应物浓度,同时减小生成物浓度
D. 增大反应物浓度,同时使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿佛加德罗常数的值,下列说法不正确的是( )
|
| A. | 常温常压下,1mol氦气含有的原子数为NA |
|
| B. | 常温常压下,8g甲烷中含有的电子数为5NA |
|
| C. | 46gNO2和N2O4混合气体中含有的原子数为3NA |
|
| D. | 标准状况下,11.2L四氯化碳所含分子数 0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
三聚氰胺,分子式C3H6N6.有毒的三鹿牌奶粉就是因为其牛奶和奶粉中添加三聚氰胺,以提升食品检测中的蛋白质含量指标.下列关于三聚氰胺的说法中你认为正确的是( )
|
| A. | 三聚氰胺由多种分子组成,所以其属于混合物 |
|
| B. | 三聚氰胺的中碳、氢、氮三种元素的质量比为12:1:14 |
|
| C. | 每摩尔三聚氰胺分子中含有原子个数为15NA |
|
| D. | 三聚氰胺的摩尔质量为126 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的饱和石灰水中加入少量CaO固体,恢复到原来温度时,下列说法正确的是( )
|
| A. | 溶液中的Ca2+总数不变 | B. | 溶液中 OH﹣数目增加 |
|
| C. | 溶质的物质的量浓度不变 | D. | 溶液的质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知钠能与水剧烈反应:2Na+2H2O=2NaOH+H2↑
(1)相同质量的Na,Mg,Al与过量的盐酸反应,在相同的状况下,三者置换出的H2的体积比是 .
(2)相同物质的量的Na,Mg,Al与过量的盐酸反应,在相同状况下,三者置换出的H2的体积比是 .
(3)Na,Mg,Al与过量的盐酸反应,在相同状况下产生的氢气的体积相等,则Na,Mg,Al三种金属的物质的量之比是.
(4)将Na,Mg,Al各0.3mol分别投入到含0.1mol HCl的盐酸中,同温同压下产生气体的体积比 .
查看答案和解析>>
科目:高中化学 来源: 题型:
含11.2g KOH的稀溶液与1L 0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列能正确表示中和热的热化学方程式是()
A. KOH(aq)+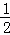 H2SO4(aq)=1/2K2SO4(aq)+H2O (l);△H=﹣11.46kJ/mol
H2SO4(aq)=1/2K2SO4(aq)+H2O (l);△H=﹣11.46kJ/mol
B. 2KOH(s)+H2SO4(aq)=K2SO4(aq)+2H2O (l);△H=﹣114.6kJ/mol
C. 2KOH(aq)+H2SO4=K2SO4(aq)+H2O (l);△H=+114.6kJ/mol
D. KOH (aq)+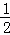 H2SO4(aq)=
H2SO4(aq)=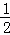 K2SO4(aq)+H2O (l);△H=﹣57.3kJ/mol
K2SO4(aq)+H2O (l);△H=﹣57.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应的反应物和产物如下:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是
②在下面的化学式上标出电子转移的方向和数目KMnO4+KI+H2SO4→
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组.原因是 . .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com