
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是氧化剂 | ||
| C. | 维生素C将Fe3+还原为Fe2+ | D. | 亚硝酸盐被氧化 |
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| W | X | Y | ||
| Z | M | Q |
| A. | W、X、Y中最简单氢化物稳定性最弱的是Y | |
| B. | Q元素形成的单质微粒间作用力除了分子间作用力还含有共价键 | |
| C. | M元素氧化物对应水化物的酸性一定强于Z | |
| D. | 电解饱和的NaM溶液可以制取H2和NaMX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于实验室制备NO气体 | |
| B. | 装置②可用于模拟海水蒸馏 | |
| C. | 装置③可用于探究碳酸氢钠的热稳定性 | |
| D. | 装置④为配制溶液过程中的定容操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①②④ | C. | ①③⑤⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 【SO2的制备】
【SO2的制备】| 药品 | 作用 | |
| A | FeCl3溶液 | 验证SO2的还原性 |
| B | Na2S溶液 | 验证二氧化硫的氧化性 |
| C | 品红溶液 | 验证二氧化硫的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧原子的结构示意图: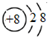 | |
| C. | 水分子的电子式: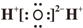 | |
| D. | 乙酸甲酯的结构简式HCOOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 分枝酸在微生物、植物的“芳香族氨基酸的生物合成系统中作为中间体,其结构简式如图.下列关于分枝酸的叙述不正确的是( )
分枝酸在微生物、植物的“芳香族氨基酸的生物合成系统中作为中间体,其结构简式如图.下列关于分枝酸的叙述不正确的是( )| A. | 分枝酸的分子式为C10H10O6 | |
| B. | 1mol分枝酸最多消耗3molNaOH | |
| C. | 分枝酸分子中含2个手性碳原子 | |
| D. | 一定条件下,分枝酸可发生取代、加成、氧化和聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁元素的化合价为+3价 | |
| B. | n 取值范围是:0<n≤6 | |
| C. | 不能在酸性较强的环境中使用 | |
| D. | 若n=2时,构成该物质的三种微粒个数比为1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜 | B. | 硝酸铜 | C. | 氢氧化铜 | D. | 氧化铜粉末 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com