
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | + | =1 | - | + | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
| A. | 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧ | |
| B. | 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4 | |
| C. | 某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于第三周期第ⅤA族 | |
| D. | 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式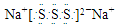 |
分析 主族元素中,元素的最高化合价数值与其族序数相等,最低化合价数值=8-其族序数,同一周期中,元素的原子半径随着原子序数增大而减小,同一主族中,元素的原子半径随着原子序数的增大而增大,
①②⑧最高正价为+1,为第IA族元素,第IA族原子半径都大于⑩原子半径,结合原子半径可知,①是Li元素、②是K元素、⑧是Na元素;
⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;
③只有-2价,为第VIA族元素,则③是O元素;
④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;
⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;
⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素;
结合物质的性质分析解答.
解答 解:主族元素中,元素的最高化合价数值与其族序数相等,最低化合价数值=8-其族序数,同一周期中,元素的原子半径随着原子序数增大而减小,同一主族中,元素的原子半径随着原子序数的增大而增大,
①②⑧最高正价为+1,为第IA族元素,第IA族原子半径都大于⑩原子半径,结合原子半径可知,①是Li元素、②是K元素、⑧是Na元素;
⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;
③只有-2价,为第VIA族元素,则③是O元素;
④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;
⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;
⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素,
A.这几种元素中,金属性最强的是K,最易失去电子,则失去核外第一个电子所需能量最少的是②,故A错误;
B.⑤是C元素、⑥是P元素、⑦是Cl元素,⑤、⑥、⑦三种元素中的两种元素形成的化合物有PCl3、CCl4、PCl5,元素化合价的绝对值+其最外层电子数=8,则该原子达到8电子稳定结构,所以每个原子都满足最外层为8电子稳定结构的物质的化学式为 PCl3、CCl4,而PCl5中P最外层不满足8电子稳定结构,故B错误;
C.某元素R的原子半径为1.02×10-10m,该原子半径在⑥⑦之间,⑥是P元素,⑦是Cl元素,则该元素是S元素,硫原子核外有16个电子,根据构造原理知,其基态原子核外电子排布式为:1S22S22P63S23P4,应位于周期表第三周期ⅥA族,故C错误;
D.若物质Na2S3是一种含有非极性共价键的离子化合物,存在S32-离子,离子中S原子之间形成1对共用电子对且都满足8电子稳定结构,故该化合物的电子式为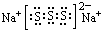 ,故D正确;
,故D正确;
故选D.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,根据元素周期律判断元素是解本题关键,D中电子式的书写是难点,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光化学烟雾的主要原因与排放SO2有关 | |
| B. | 工业上用二氧化硫来漂白纸浆、毛、丝、草帽、食品等 | |
| C. | 闪电时,大气中常伴有少量的NO2产生 | |
| D. | 正常雨水的PH小于5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在5-氨基四唑(
在5-氨基四唑(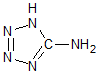 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
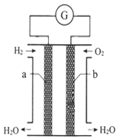 氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )
氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )| A. | 在电池反应中每转移2mol电子,正极消耗O2的体积为11.2L | |
| B. | b极的电极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液碱性减弱 | |
| D. | 该装置将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2Cl在碱性溶液中水解 | |
| B. | CH2═CH-CH═CH2与H2按物质的量之比为1:1进行反应 | |
| C. | CH3CH═CH2与HCl加成 | |
| D. |  与NaOH的醇溶液共热 与NaOH的醇溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0 则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol 则H2的燃烧热为285.8 kJ/mol | |
| C. | 已知2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol 则C(碳)的燃烧热为110.5 kJ/mol | |
| D. | 已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol 则该反应的中和热为114.6 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com