
【题目】茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( ) 
A.将茶叶灼烧灰化,选用②、④和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+ , 选用③、⑧和⑩
【答案】A
【解析】解:A.将茶叶灼烧灰化,应在坩埚中加热,用到的仪器有①、②和⑨,必要时还可用到三脚架或铁架台带铁圈,不需要④,故A选;B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,应在烧杯中进行,可用玻璃棒搅拌,选用④和⑦,故B不选;
C.过滤时用到④、⑤和⑦,故C不选;
D.检验滤液中的Fe3+ , 可用胶头滴管取少量滤液于小试管中,用KSCN溶液检验,用到的仪器有试管、胶头滴管和滴瓶等,即③、⑧和⑩,故D不选;
故选A.
检验茶叶中的铁元素,先将茶叶在坩埚中灼烧灰化,然后在烧杯中用浓硝酸溶解茶叶灰并加蒸馏水稀释,在漏斗中过滤,可取少量滤液于小试管中,用KSCN溶液检验,以此解答该题.


科目:高中化学 来源: 题型:
【题目】关于容量瓶的四种叙述:①是配制准确浓度的仪器;②不宜贮藏溶液 ③不能用来加热;④使用之前要检査是否漏水。这些叙述中正确的是
A. ①②③④ B. ②③ C. ①② D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于300mL 1molL﹣1盐酸与铁片的反应,其中能使反应速率加快的措施( )
A.升高温度
B.再加300mL 1 molL﹣1盐酸
C.用等量铁片代替铁粉
D.改用100mL 98%的硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是
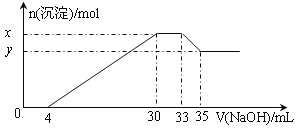
A. X与Y的差值为0.01 mol
B. 原溶液中c(Cl-)=0.66mol·L-1
C. 原溶液的c(H+)=0.8 mol·L-1
D. 原溶液中n(Mg2+)∶n(Al3+)=10∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某两种气态烃的1L混合气体,完全燃烧生成1.4LCO2和2.0L水蒸气(体积均在相同状况下测得),该混合物可能是( )
A.乙烷、乙烯
B.甲烷、乙烯
C.甲烷、丙烯
D.乙烷、丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S气体。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华,氢硫酸为弱酸。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
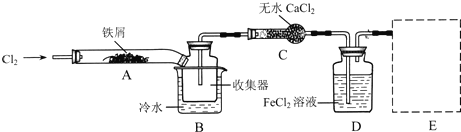
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为_______________________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作应该是__________________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为_______________________________________________;装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂_______________________________________________。
(5)在虚线框中画出尾气吸收装置E并注明试剂。(在答题卡上画)____________
(6)FeCl3溶液与H2S气体反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数.
甲方案:
实验步骤为:①称量空坩埚的质量为A g ②称量装有试样的坩埚质量为B g ③加热④冷却⑤称量坩埚和残余物的质量为C g⑥重复③至⑤操作,直至恒重,质量为D g.
(1)坩埚中发生反应的化学方程式为 .
(2)计算Na2CO3质量分数必须用到的测定数据为(填“A”、“B”、“C”或“D”).
乙方案:
在天平上准确称取0.3000g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.1000mo1L﹣1 , 的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3 . 重复上述操作两次,消耗盐酸的体积为20.00mL.
(3)配制上述盐酸标准溶液100mL,若用2.0molL﹣1HCl进行配制,需用滴定管量取该HCl溶液mL;定容时俯视刻度线,将导致配制的溶液浓度(填“偏高”、“偏低”或“没有影响”).
(4)样品中Na2CO3的质量分数为(用百分数表示,精确到0.1%).
丙方案:称取m g样品,选用如图部分装置测定样品与硫酸反应生成的气体体积.
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b.若装置不漏气,则观察到的现象为 . 实验时,装置A中c的作用、 .
(6)为了提高测定的准确性,应选用装置A和(填写字母标号)进行实验.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al2(SO4)3和MgSO4混和,加适量水溶解,再加入KOH溶液,析出的沉淀量(W)与KOH溶液体积(V)的关系如图,则Al2(SO4)3和MgSO4的物质的量之比是( )
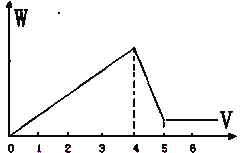
A. 2:1 B. 1:2 C. 1:1 D. 1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com