
分析 ①实验测得A溶液和D溶液显碱性,则A、D分别为中的一种Ba(OH)2、Na2CO3;B溶液和C溶液显酸性,B、C分别为(NH4)2SO4、A1C13中的一种;
②A溶液和D溶液混合可生成沉淀甲,甲为硫酸钡或碳酸钡;
③足量A溶液与B溶液混合共热沉淀乙和刺激性气味气体,可知乙为硫酸钡,气体为氨气,即A为Ba(OH)2,D为Na2CO3,B为(NH4)2SO4,C为A1C13,以此来解答.
解答 解:(1)由上述分析可知,A为Ba(OH)2,D为Na2CO3,故答案为:Ba(OH)2;Na2CO3;
(2)C为A1C13,将C溶液加热蒸干,水解生成盐酸挥发,并灼烧至恒重,氢氧化铝分解生成氧化铝,则最后得固体为Al2O3,故答案为:Al2O3;
(3)B为(NH4)2SO4,铵根离子水解显酸性,且水解程度不大,则离子浓度为c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(4)碳酸钡可发生沉淀的转化生成硫酸钡,则沉淀甲加入到B溶液中,沉淀甲会转化为沉淀乙.沉淀甲会转化为沉淀乙的离子方程式是BaCO3(s)+SO42-(aq)=BaSO4(s)+CO32-(aq),故答案为:BaCO3(s)+SO42-(aq)=BaSO4(s)+CO32-(aq).
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与推断能力的考查,刺激性气体为氨气为推断的突破口,注意元素化合物知识的应用,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:实验题
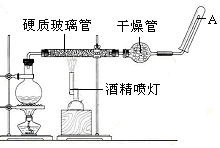 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-═H2O | |
| B. | H2S在水溶液中的电离:H2S+H2O?H3O++HS- | |
| C. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| D. | NH4HCO3溶于过量的NaOH溶液中:HCO32-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称是2,5,5-三甲基-3-乙基-庚烷
的名称是2,5,5-三甲基-3-乙基-庚烷 .
. .
.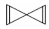 D.
D. 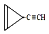 ,其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式:CH≡C-C≡C-CH3.
,其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式:CH≡C-C≡C-CH3.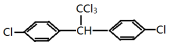 分子中最多有23个原子共面.
分子中最多有23个原子共面.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中Al3+、NH4+、Cl-、S2- | B. | 酸性溶液中Na+、ClO-、SO42-、I- | ||
| C. | 强碱性溶液中Na+、K+、Cl-、CO32- | D. | 中性溶液中Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾酸性溶液与草酸钾溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | KI的酸性溶液长期置于空气中::4I-+4H++O2═2I2+2H2O | |
| C. | 硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O | |
| D. | 用食醋除去水垢:CO32-+2CH3COOH═H2O+CO2↑+2CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com