
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:选择题
| t/℃ | 700 | 800 | 830 | 1 000 |
| K | 0.6 | 0.9 | 1.0 | 1.7 |
| A. | 上述生成CO和H2O的反应为放热反应 | |
| B. | 加压、增大H2浓度和加入催化剂都能提高CO2的转化率 | |
| C. | 830℃达平衡后,再充入1.0 mol H2,K值增大,平衡正向移动 | |
| D. | 830℃时反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
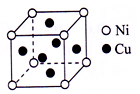 苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金.Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成SO4深蓝色溶液.
苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金.Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成SO4深蓝色溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
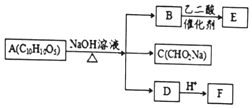 某芳香化合物A有如下转化:
某芳香化合物A有如下转化: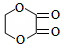 1mol F 最多消耗2mol NaOH.
1mol F 最多消耗2mol NaOH.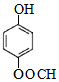
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4 L C2H6中含共价键的数目为6 NA | |
| B. | 5 g KHCO3与CaCO3混合固体中阴离子数目为0.05 NA | |
| C. | 常温下,1 L 0.1 mol•L-1CH3COONa溶液中CH3COO-离子数目为0.1 NA | |
| D. | 在Na2O2与H2O的反应中,当转移0.2 NA个电子时生成的O2体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为35、中子数为45的溴原子:3545Br | |
| B. | Al3+的结构示意图: | |
| C. | 羟基的电子式: | |
| D. | 乙醇的结构简式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g铁粉与酸反应失去的电子数是NA | |
| B. | 标准状况下,11.2 L NH3含有的原子总数为1.5NA | |
| C. | 0.5 mol•L-1 K2SO4溶液中所含K+的数目为NA | |
| D. | 46 g N02和N2O4的混合气体含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com