
【题目】电解质在水溶液中存在各种行为,如电离、水解等,依据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6mol·L-1,该温度下,pH=10的NaOH溶液的物质的量浓度为___。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl②NH3·H2O③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序为___(填标号)。
(3)25℃时,将amol·L-1的醋酸和bmol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则a___b(填“>”“<”或“=”)。
【答案】0.01mol·L-1 ④①②③ >
【解析】
(1)t℃时,纯水中c(H+)=c(OH-)=1×10-6molL-1,则该温度下水的离子积常数KW=c(H+)c(OH-);该温度下,pH=10的Ba(OH)2溶液中c(OH-)=![]() mol/L=0.01mol/L,c(NaOH)= c(OH-);
mol/L=0.01mol/L,c(NaOH)= c(OH-);
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中c(H+)、碱中c(OH-)越大其抑制水电离程度越大;
(3)25℃时,将amolL-1的醋酸和bmolL-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(CH3COO-)=0.5bmol/L,溶液中存在物料守恒c(CH3COO-)+c(CH3COOH)=0.5amol/L。
(1)t℃时,纯水中c(H+)=c(OH)=1×106molL1,则该温度下水的离子积常数KW=c(H+)c(OH)=1×106×1×106=1012;该温度下,pH=10的NaOH溶液中c(OH)=![]() mol/L=0.01mol/L,c c(NaOH)= c(OH-)=0.01mol/L;
mol/L=0.01mol/L,c c(NaOH)= c(OH-)=0.01mol/L;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中c(H+)、碱中c(OH)越大其抑制水电离程度越大,①不影响水电离,②中c(OH)小于③中c(H+)且二者都抑制水电离程度,水电离程度②>③,④中铵根离子水解促进水的电离,所以水电离程度大小顺序是④①②③;
(3)25℃时,将amolL1的醋酸和bmolL1的氢氧化钠溶液等体积混合后,溶液的pH=7,则c(H+)=c(OH),根据电荷守恒得c(Na+)=c(CH3COO)=0.5bmol/L;溶液体积增大一倍,浓度是原来的一半,溶液中存在物料守恒c(CH3COO)+c(CH3COOH)=0.5amol/L>c(CH3COO)=0.5bmol/L,所以a>b。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约![]() ,在低于
,在低于![]() 时,泡沫具有永久磁性,下列叙述正确的是( )
时,泡沫具有永久磁性,下列叙述正确的是( )
A.“碳纳米泡沫”是一种胶体
B.“碳纳米泡沫”是一种新型的碳化合物
C.“碳纳米泡沫”在一定条件下能吸引磁铁
D.“碳纳米泡沫”与石墨的相互转化不属于化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种物质的分子式相同,但分子的空间结构不同,可以实现下列转化:
1molX![]() 1molY
1molY![]() 1molZ。下列说法正确的是( )
1molZ。下列说法正确的是( )
A.物质Y比X稳定.B.物质Y比Z稳定
C.X转化为Y是放出能量D.X转化为Z是吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。回答下列问题:
(1)已知:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=-45.8kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277.0kJ·mol-1
则2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)ΔH3=____。
(2)电化学法还原二氧化碳为乙烯原理如图所示。
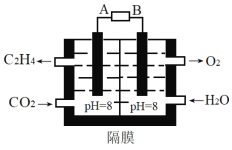
A为电源的___极(填“正”或“负”),阴极电极反应式为___。电路中转移0.2mol电子,理论上产生氧气___L(标准状况)。
(3)铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是___(填标号)。
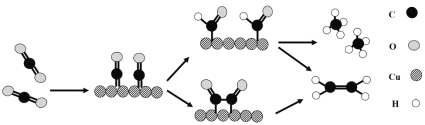
A.铜是二氧化碳转化为乙烯的催化剂
B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )
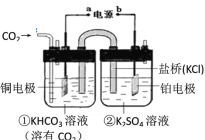
A.该过程是电能转化为化学能的过程
B.铜电极为阴极,发生还原反应
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH一定下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
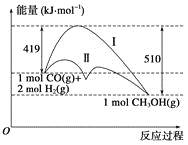
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1:45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O,该反应的化学方程式为_____________。
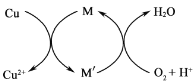
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:
①称取样品2.2320g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25. 00mL溶液A,加入足量AgNO3溶液,得AgCl 0. 3444g;
③另取25. 00mL溶液A,调节pH 4 ~ 5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液60.00mL。通过计算确定该样品的化学式(写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.用惰性电极电解MgCl2溶液:2Cl-+H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.碳酸钠溶液显碱性:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
C.氯气通入冷水中:Cl2 +H2O ![]() Cl-+ClO-+2H+
Cl-+ClO-+2H+
D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH= 2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 中含有的
中含有的![]() 键数目为
键数目为![]()
B.标况下![]() 的
的![]() 分子,含共用电子对数
分子,含共用电子对数![]()
C.![]() 分别与足量的
分别与足量的![]() 和
和![]() 充分反应后转移的电子数均为
充分反应后转移的电子数均为![]()
D.![]() 的盐酸与氨水混合后溶液呈中性,则
的盐酸与氨水混合后溶液呈中性,则![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com