
(5分)某种电池的电极材料为Al和Mg,电解质溶液为KOH,
(1) 电池的负极的电极反应式为__________
正极发生的是_______________反应(填反应类型);
(2) 总反应______________________________________________________________。
科目:高中化学 来源: 题型:
查看答案和解析>>
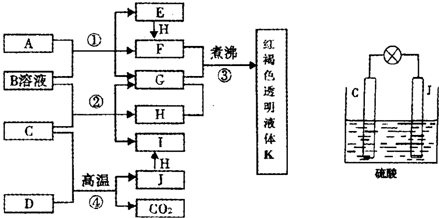
科目:高中化学 来源:不详 题型:问答题
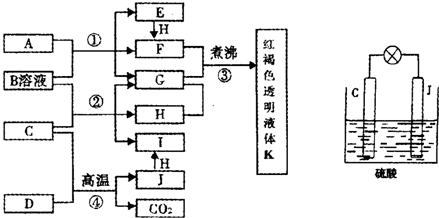
查看答案和解析>>
科目:高中化学 来源:四川省模拟题 题型:推断题
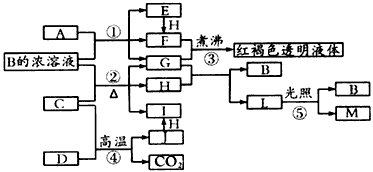
查看答案和解析>>
科目:高中化学 来源: 题型:
已知D、M、H是常见的非金属单质,其中M是无色气体,H是有色气体,J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1 mol H同时消耗4 mol B和1 mol C,K只知含有CO或CO2中的一种或两种。它们关系如图:w_w*w.k*s 5*u.c*o m
w_w w. k#s5_u.c o*m
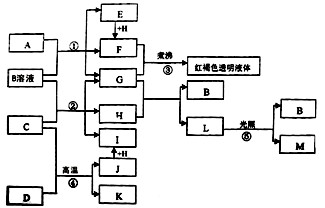
(1)写出下列物质的化学式:A D
(2)写出下列反应的化学方程式:
②
⑤
(3)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用 方法(填序号)①热分解法②热还原法 ③电解法 其中从A得到其相应金属也可用铝热法,若反应中1 mol A参加反应,转移电子的物质的量为
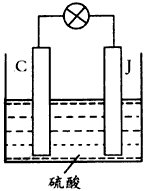
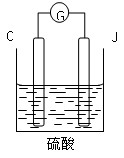
(4)用C、J作电极,与硫酸构成如下图所示电池,正极的电极反应为 当反应转移1 mol电子时,负极质量增加 gw_w*w.k*s 5*u.c*o m
查看答案和解析>>
科目:高中化学 来源:2011年高考化学模拟试卷(新课标卷)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com