
【题目】(14分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
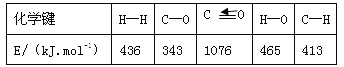
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
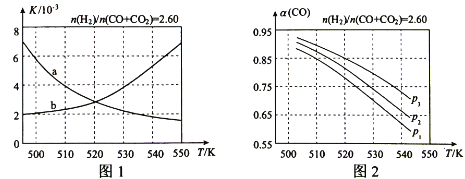
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
【答案】(1)—99;+41(2)![]() ;a;反应①为放热反应,平衡常数应随温度升高变小;
;a;反应①为放热反应,平衡常数应随温度升高变小;
(3)减小;升高温度时,反应①为放热反应,平衡向向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又产生CO的量增大;总结果,随温度升高,使CO的转化率降低;P3>P2>P1;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高
【解析】
(1)反应热等于断键吸收的能量与形成化学键所放出的能量的差值,则根据表中数据和反应的化学方程式CO(g)+2H2(g)![]() CH3OH(g)可知反应热△H1=1076kJ/mol+2×436 kJ/mol—3×413 kJ/mol—343 kJ/mol—465 kJ/mol=—99kJ.mol-1。根据盖斯定律可知②—①即可得到反应③,则△H3=—58 kJ/mol+99 kJ/mol=+41kJ.mol-1。
CH3OH(g)可知反应热△H1=1076kJ/mol+2×436 kJ/mol—3×413 kJ/mol—343 kJ/mol—465 kJ/mol=—99kJ.mol-1。根据盖斯定律可知②—①即可得到反应③,则△H3=—58 kJ/mol+99 kJ/mol=+41kJ.mol-1。
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则反应①的化学平衡常数K的表达式为![]() ;由于正方应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,因此a正确。
;由于正方应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,因此a正确。
(3)反应①为放热反应,升高温度时,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又产生CO的量增大;因此最终结果是随温度升高,使CO的转化率降低;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高,所以图2中的压强由大到小为P3>P2>P1。


科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如右下图所示的关系。下列说法不正确的是
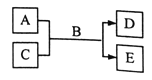
A. 离子半径大小关系:Y>Z>X>W
B. YX2遇到蓝色石蕊试液先变红后褪色
C. 简单阴离子的还原性:Y>Z
D. Y与Z属于同一周期,与X属于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )


A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.2p2表示2p能级有两个轨道
B.在CS2分子中α键与π键的数目之比是2︰1
C.电子仅在激发态跃进到基态时才会产生原子光谱
D.表示一个某原子在第三电子层上有10个电子可以写3s23p63d2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 ,下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 ,下列推断中正确的是( )
A. 放电时,Fe为正极,Ni2O3为负极
B. 充电时,阴极上的电极反应式是Fe(OH)2+2e- + 2H+ = Fe+2H2O
C. 充电时,Ni(OH)2为阳极,发生还原反应
D. 该蓄电池的电极是浸在某种碱性电解质溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图甲、乙两个容器中,分别加入0.1 mol·L-1的NaCl溶液与0.1 mol·L-1的AgNO3溶液后,以Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为( )
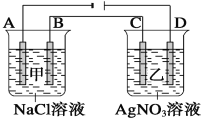
A. 2∶2∶4∶1
B. 2∶3∶4∶1
C. 1∶4∶2∶2
D. 1∶1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是
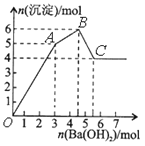
氢氧化物 | 溶液pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.3 | 3.4 |
Al(OH)3 | 3.3 | 5.2 |
A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4↓+Al(OH)3↓
D. C点溶液呈碱性是因为AlO2-水解,离子方程式为:AlO2-+2H2O=Al(OH)3+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com