
| A. | 氨水显碱性:NH3•H2O═NH4++OH- | |
| B. | 将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2Cl- | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
分析 A.一水合氨为弱碱,在溶液中部分电离出铵根离子和氢氧根离子,电离方程式用可逆号;
B.钠与水反应生成氢氧化钠和氢气;
C.通电后氯化铜被电解生成铜和氯气;
D.Al与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:A.一水合氨部分电离出铵根离子和氢氧根离子,导致氨水显碱性,电离方程式为:NH3•H2O?NH4++OH-,故A错误;
B.将Na块放入水中生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2NaOH+H2↑,故B正确;
C.用CuCl2溶液做导电实验,灯泡发光,发生电解生成铜和氯气,正确的反应为:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2,故C错误;
D.Al溶于NaOH溶液中,产生气体,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故D正确;
故选AC.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
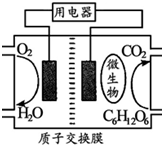 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 动物皮革的主要成分是蛋白质,且天然蛋白质水解的最终产物是氨基酸 | |
| C. | 苯和乙烯都可以与溴的四氯化碳溶液反应而使之褪色 | |
| D. | 石油分馏可获得乙酸,苯及其衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:
工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
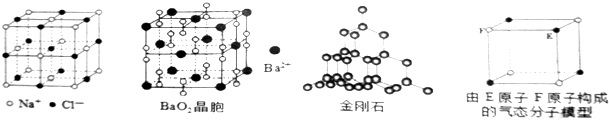
| A. | 在NaCI晶体中,距Na+最近的Cl-有6个 | |
| B. | 在BaO2晶胞中,每个晶胞平均占有4个Ba2+和4个022- | |
| C. | 在金刚石晶体中,碳原子与碳碳键的个数比为1:2 | |
| D. | 该气态分子的分子式为EF或FE |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com