
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
分析 (1)由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,据此判断;
(2)依据苯是有机溶剂,碘单质易溶解于苯来分析;
(3)平衡常数只受温度影响,与物质的浓度无关.
解答 解:(1)由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应方向为放热反应,即△H<0,
故答案为:<;
(2)苯会萃取水中的碘,使碘浓度下降,平衡逆向移动,
故答案为:逆反应;
(3)加入KI固体,平衡向右移动,但平衡常数只受温度影响,与物质的浓度无关,加入少量KI固体,平衡常数K不变,
故答案为:不变.
点评 本题考查温度对化学平衡的影响、化学平衡常数及影响因素,难度不大,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:选择题
如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是
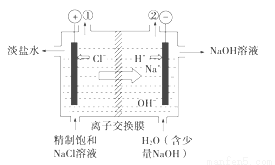
A.装置出口①处的物质是氯气
B.出口②处的物质是氢气,该离子交换膜只能让阳离子通过
C.装置中发生的反应的离子方程式2Cl ﹣+2H+
﹣+2H+ Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
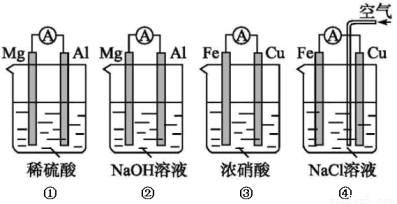
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-=Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e -=H2↑
-=H2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且 不影响生成氢气的总量,可向盐酸中加入适量的:
不影响生成氢气的总量,可向盐酸中加入适量的:
①NaOH固体;②H20;③CH3COONa固体;④NaN03固体;⑤KCl溶液。
A.①② B.②③⑤ C.②④ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
| A. | 500s时O2的浓度为0.075mol/L | |
| B. | 平衡后,升高温度,正反应速率先增大后减小 | |
| C. | 平衡后,要使平衡常数增大,改变的条件是升高温度 | |
| D. | 1000s时将容器的体积缩小一半,重新达到平衡时0.25mol/L<c(N2O5)<0.50mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水;无水CaCl2 固体 | B. | 饱和NaHCO3 溶液; 浓H2SO4 | ||
| C. | 浓H2SO4; 饱和NaHCO3 溶液 | D. | 饱和NaHCO3 溶液; 稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 7 | C. | 9 | D. | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com