
【题目】工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)-236kJ,完成下列填空:
Si(s)+4HCl(g)-236kJ,完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为 2L,经 3min 后达到平衡,获得固体的质量 8.4 g,则用 H2 表示的平均反应速率为_________。
(2)该反应的平衡常数表达式 K=_________,若欲使 K 增大,可采取的措施是_________。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是_________。
a.2v 逆(SiCl4)=v 正(H2) b.断开 4mol Si-Cl 键的同时,生成 4mol H-Cl 键
c.混合气体密度保持不变 d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第 1.5 分钟v(正) ____ v(逆)(填><或=),第 3 分钟改变的条件是_______,各平衡态中氢气转化率最小的时间段是_______。
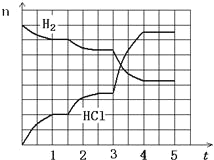
【答案】0.1 mol/(L·min) 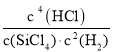 升温 ac > 升温 1-1.5min
升温 ac > 升温 1-1.5min
【解析】
(1)根据反应SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),获得固体的质量 8.4 g,该固体为硅单质,即生成
Si(s)+4HCl(g),获得固体的质量 8.4 g,该固体为硅单质,即生成![]() =0.3mol硅单质需要氢气0.6mol,则用 H2 表示的平均反应速率为
=0.3mol硅单质需要氢气0.6mol,则用 H2 表示的平均反应速率为 =0.1 mol/(L·min),
=0.1 mol/(L·min),
答案为:0.1 mol/(L·min);
(2)根据反应SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) -236kJ,据化学方程式和平衡常数的概念计算得到平衡常数K=
Si(s)+4HCl(g) -236kJ,据化学方程式和平衡常数的概念计算得到平衡常数K=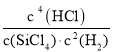 ;反应是吸热反应升温反应正向进行,平衡常数增大,
;反应是吸热反应升温反应正向进行,平衡常数增大,
答案为: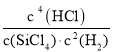 ;升温;
;升温;
(3)在密闭恒容容器中,SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)
Si(s)+4HCl(g)
a.依据化学反应速率之比等于化学方程式系数之比,2v正(SiCl4)=v正(H2)所以 2v逆(SiCl4)=v正(H2)说明四氯化硅正逆反应速率相同,证明反应达到平衡,故a正确;
b.断开4mol Si-Cl键的同时,生成4mol H-Cl键,表示的是反应正向进行,故b错误;
c.正向进行气体质量减小,气体体积不变,混合气体密度保持不变,证明反应达到平衡,故c正确;
d.c(SiCl4):c(H2):c(HCl)=1:2:4,反应过程中符合化学方程式的系数之比,不能判断反应达到平衡,故d错误;
故答案为:ac;
(4)分析图象可知第1.5分钟,氢气减小,氯化氢增大,改变的条件是减少压强平衡正向进行,v(正) >v(逆);第3分钟曲线变化斜率大,反应速率大,反应正向进行,反应是吸热反应,改变的条件是升温;由图像可得,1-1.5min,平衡不移动,氢气转化率最小,
故答案为:>,升温,1-1.5min;


科目:高中化学 来源: 题型:
【题目】已知丁酸跟乙酸具有相似的化学性质,丁醇跟乙醇具有相似的化学性质:CH3CH2CH2CH2OH丁醇 CH3CH2CH2COOH丁酸
试回答下列问题:
(1)分别写出丁醇、丁酸与Na反应的化学方程式:
丁醇+钠:___________________________________;
丁酸+钠:________________________________________。
预计上述化学反应的速率:v(丁醇)________v(丁酸)(填“>”或“<”)。
(2)写出丁酸与丁醇的酯化反应,并注明反应条件________________________________。
(3)写出丁醇在Ag催化下与O2的反应______________________。
(4)判定丁醇能否直接被氧化为丁酸。若能,指出所用氧化剂是什么________(若不能,此空不填);若不能,请说明理由____________________(若能,此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界锂离子电池总产量超过30亿只,锂电池消耗量巨大,黄石一重点中学化学研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如图:
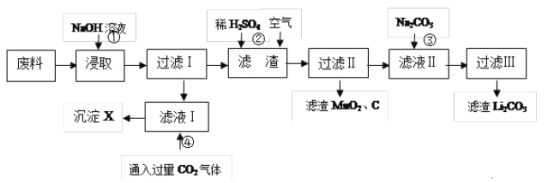
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)写岀氢氧化钠的电子式___。
(2)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是___。
(3)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求___。
(4)写出反应④生成沉淀X的离子方程式___。
(5)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:___。
(6)生成Li2CO3的化学反应方程式为___。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列叙述正确的是
A. 78g苯中含有的碳碳双键的数目为3NA
B. 16gCu2S和CuO组成的混合物中含有的阳离子数为0.2NA
C. 将1mol H2与 1 mol I2充入一密闭容器中充分反应后,转移的电子书为2NA
D. 1 mol Fe 与足量的浓硫酸共热反应,生成SO2的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
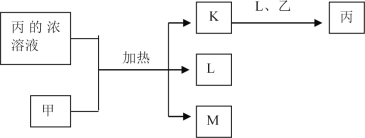
A. 原子半径:W<X<Y B. 元素的非全属性:Z>Y>X
C. 化合物XYZ中只含共价键 D. K、L、M中沸点最高的是M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染问题日益引起全民关注。
(1)PM 2.5是指大气中直径小于或等于2.5μm(1μm=100nm)的颗粒物。下列说法不正确的是_______(填字母代号)。
a.PM 2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM 2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,该新工艺既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
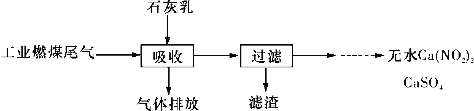
①CaSO4可以调节水泥的硬化时间,尾气中SO2与石灰乳反应生成CaSO4的化学方程式为_______________________________________________________。
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式为__________________________________________。
(3)空气中的铅污染可用火焰原子吸收分光光度法分析。已知PbO2在加热过程中发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0% ![]() 的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值。(结果保留一位小数)(要求写出计算过程)。____________
的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值。(结果保留一位小数)(要求写出计算过程)。____________
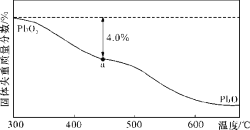 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-空气电池是一种新型燃料电池,其工作原理如图所示。下列说法错误的是( )
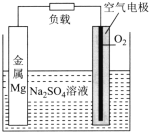
A.金属Mg电极为负极,其电势低于空气电极的电势
B.电子流向:Mg电极→导线→空气电极→电解质溶液→Mg电极
C.电池总反应为2Mg+O2+2H2O=2Mg(OH)2
D.回收后的氢氧化镁经一系列转化,可重新制成镁锭循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应原理和实验装置(加热装置略)如下:![]() +HO—NO2
+HO—NO2![]()
![]() +H2O
+H2O
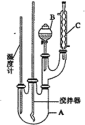
下列有关说法正确的是
A.反应结束后,冷却至室温倒入分液漏斗中。依次用水,5%的NaOH溶液,水洗涤,然后加入CaCl2干燥后,过滤,可得到高纯度的硝基苯。
B.用本套仪器也可以制备溴苯
C.装置C的作用是冷凝回流。其中冷凝水从C的下口流出
D.纯净的硝基苯是无色的,但实验所得硝基苯呈黄色,主要是由于溶解了苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com