
| A�� | �ϳɰ���Ӧ�ڵ������ܹ��Է����У�����Ϊ��Ӧ�����֮�ʹ������������֮�� | |
| B�� | Ԫ�ط����ǿ���ȷ���������Ƿ���C��H��O��N��S��Cl��Br��Ԫ�أ�ԭ�����չ�����ȷ�������к�����Щ����Ԫ�� | |
| C�� | ��������Ԫ���������ڹ���Ԫ����Ѱ�Ҹ������������Ĵ������Խ��ͻ�ѧ��Ӧ�Ļ�ܣ��Ӷ��ܺõĽ���Ч�� | |
| D�� | ���߷ֱ���ӫ�������ܹ��۲쵽���׳߶ȵ����ʣ��������Ի�õ�������Һ�еķ���ͼ�� |
���� A���ϳɰ���Ӧ�ڵ������ܹ��Է����У�����Ϊ�Ͽ��ɻ�ѧ������Ҫ�������ϵͣ�
B��Ԫ�ط�������Ϊһ��ʵ���ҳ�����������ͬʱ���л��Ĺ��塢�ӷ��Ժ�������������C��H��O��N��S��Cl��Br��Ԫ�صĺ������ж��������ⶨ��
C�������ܼӿ췴Ӧ���ʣ����ͻ�ѧ��Ӧ�Ļ�ܣ�
D�����ù�ѧ�������Թ۲��ϸ���ڵ����ʵȴ���ӣ��ݴ˽�ɣ�
��� �⣺A���ϳɰ���Ӧ�ڵ������ܹ��Է����У�����Ϊ�Ͽ��ɻ�ѧ������Ҫ�������ϵͣ�����Ҫ�ϸߵ��¶ȣ���A����
B��Ԫ�ط�������Ϊһ��ʵ���ҳ�����������ͬʱ���л��Ĺ��塢�ӷ��Ժ�������������C��H��O��N��S��Cl��Br��Ԫ�صĺ������ж��������ⶨ����B��ȷ��
C�������ܼӿ췴Ӧ���ʣ����ͻ�ѧ��Ӧ�Ļ�ܣ���C��ȷ��
D��2014�������ѧ�������ֱ���ӫ��������ŵ������ѧ����ʹ��ѧ�����ֱ��ʲ���������ʱ�������ô����ѧ�������Թ۲��ϸ���ڵ����ʵȴ���ӣ���D��ȷ����ѡA��
���� ����Ϊ�ۺ��⣬�����˻�ѧʷ���о���ѧ�ķ����������ĸ�ʴ�����ԭ�����������֪ʶ���ɽ��ע��Ի���֪ʶ�Ļ��ۣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ޢߢ� | B�� | �٢ݢ� | C�� | �٢ܢݢ� | D�� | �٢ܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����£���0.1mol/L��ˮ�ֱ�ζ�20.0mL��0.1mol/L������ʹ��ᣬ������ͼ��ʾ������˵����ȷ�ģ�������
�����£���0.1mol/L��ˮ�ֱ�ζ�20.0mL��0.1mol/L������ʹ��ᣬ������ͼ��ʾ������˵����ȷ�ģ�������| A�� | I���߱�ʾ���ǵζ���������� | |
| B�� | x=20 | |
| C�� | �ζ�������$\frac{c��N{H}_{4}^{+}��}{c��N{H}_{3}•{H}_{2}O��}$��ֵ��С | |
| D�� | ��I���ߺ�II����pH��Ϊ7ʱ��һ��Һ�е�c��Cl-��������һ��Һ�е�c��CH3COO-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
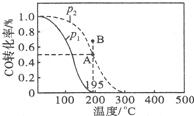 �״�����Ҫ�Ļ���ԭ�ϣ��ڻ����������й㷺��Ӧ�ã�
�״�����Ҫ�Ļ���ԭ�ϣ��ڻ����������й㷺��Ӧ�ã�| t/min | 0 | 1 | 3 | 5 |
| n��H2��/mol | 8 | 5 | 4 | 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
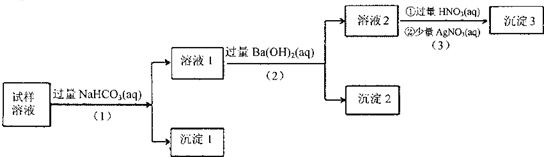
| A�� | ����2�����ڿ����У����������ӣ������п϶�����SO32- | |
| B�� | ������Һ�м����Թ�����NH4C1��Һ�ܵõ������1�ɷ���ͬ������ | |
| C�� | �������̲��裨1����2����3����˳���Ϊ��3����2����1�������ܻ�����ͬ��ʵ������ | |
| D�� | ������Һ�п϶�����A102-��Cl-������Na+��K+���ٴ���1�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol�ױ���C-H������ĿΪ6NA | |
| B�� | ��Ӧ5NH4NO3$\frac{\underline{\;\;��\;\;}}{\;}$2HNO3+4N2��+9H2O������28gN2ʱ��ת�Ƶ�����ĿΪ15NA | |
| C�� | 1molFeCl3��ˮ��Ӧ��ȫת��Ϊ������������������ӵ���ĿΪNA | |
| D�� | ����4.6g��Ԫ�صĹ������ƺ������ƵĻ�����У�������������Ϊ0.3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
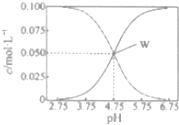 25��ʱ����c��CH2COOH��+c��CH2COO-��=0.1mol•L-1��һ����ᡢ�����ƻ����Һ����Һ��c��CH2COOH����c��CH2COO-����pH�Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ����������ȷ���ǣ�������
25��ʱ����c��CH2COOH��+c��CH2COO-��=0.1mol•L-1��һ����ᡢ�����ƻ����Һ����Һ��c��CH2COOH����c��CH2COO-����pH�Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ����������ȷ���ǣ�������| A�� | 25��ʱ������ĵ��볣��Ka=1��10-4.75 | |
| B�� | W������ʾ����Һ�У�c��Na+��+c��H+��=c��CH3COOH��+c��OH-�� | |
| C�� | pH=5.5����Һ�У�c��CH3COOH����c��CH3COO-����c��H+����c��OH-�� | |
| D�� | pH=3.5����Һ�У�c��Na+��+c��H+��-c��OH-��+c��CH3COOH��=0.1mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ����Ϊˮ���Ĵ���� | |
| B�� | �ع��;���������������������� | |
| C�� | Ư�۳��ڱ�¶�ڿ����л����ʧЧ | |
| D�� | ú̿ȼ�չ��̰�װ����װ�ã�����Ч���ú�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com