
【题目】某烃1mol 最多能和2molHBr 加成反应,其所得的产物又能跟8molBr2 发生取代反应,最后得到一种只含碳、溴两种元素的化合物,则原烃为( )
A. C4H6 B. C3H4 C. C3H6 D. C2H2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:
CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl
据此,某学生设计了下列实验.
【制备NaClO溶液】实验装置如下图左图所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3

(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图右图所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2 H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品,B装置的名称是______________
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol.L-1 的I2溶液滴定。
已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述正确并且有因果关系的是( )
A. SiO2有导电性,可用于制备光导纤维
B. 浓硫酸具有氧化性,可用于干燥H2
C. Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
D. FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据我省中心气象台报道,近年每到春季,我省很多城市多次出现大雾天气。根据物质的分类,雾属于下列分散系中的
A. 胶体 B. 悬浊液 C. 乳浊液 D. 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与氨反应,研究氨的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
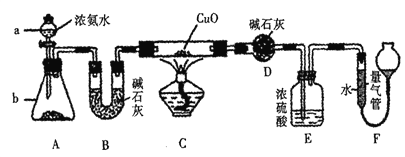
(1)仪器a的名称为 _________。
(2)实验室中,利用装置A,还可制取的无色气体是_________(填字母)。
A.Cl2 B.04 C.C02 D.N02
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管内有无色无味的气体生成,上述现象证明氨气具有________性,写出相应的化学方程式 __________。
(4) D装置的作用是 __________。
(5) E装置中浓硫酸的作用是__________。
(6)读取气体体积前,应对装置F进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2+3H2 ![]() 2NH3为放热反应,对该反应的下列说法中正确的是 ( )
2NH3为放热反应,对该反应的下列说法中正确的是 ( )
A. N2的能量一定高于NH3
B. H2的能量一定高于NH3
C. 1 mol N2和3 mol H2的总能量一定高于2 mol NH3的总能量
D. 因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次递增。己知:
①已知F为第四周元素,除最外层只有一个电子外,其他各层上均填满电子,另外五种元素均为短周期主族元素;②A、C原子p轨道的电子数分别为2和4;③D原子最外层电子数为偶数;④E原子价电子(外围电子)排布为msnmpn-1。请回答下列问题:
(1)下列叙述正确的是_____(填序号)。
A.金属键的强弱:D>E B.基态原子第一电离能:D>E
C.六种元素中,电负性最大的元素是E D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为______;与F同一周期的元素中基态原子轨道上成单电子数最多的元素为______ (填元素符号)。
(3)A与C形成的非极性分子,该分子与过量强碱反应生成的酸根离子的空间构型为_____。
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同,B 3-中心原子的杂化轨道类型为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇、环丙烷、1-丁烯三种物质组成的混合物中氧元素的质量分数为8.0%,则混合物中氢元素的质量分数为
A. 12.0% B. 13.0% C. 14.0% D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有_____________(填“氧化性”或“还原性”),Fe3+有_____________(填“氧化性”或“还原性”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com