
| 溶液① | 固体② | 溶液③ | 实验结论 |  | |
| A | 稀硫酸 | Na2CO3 | Na2SiO3 | 非金属性:C>Si | |
| B | 浓盐酸 | MnO2 | Na2S | 氧化性:Cl2>S | |
| C | 盐酸 | CaCO3 | C6H5ONa | 酸性:碳酸>苯酚 | |
| D | 稀硫酸 | Na2CO3 | CaCl2 | CO2不与氯化钙反应 |
| A、A | B、B | C、C | D、D |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、△H1>0,△H2>0 |
| B、△H3>0,△H4>0 |
| C、△H2=△H4+△H5 |
| D、△H3=△H1-2△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀硫酸去除铜器表面的Cu2(OH)2CO3:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O |
| B、用稀硝酸去除试管内壁的银镜:Ag+NO3-+2H+=Ag++NO2↑+H2O |
| C、向AlCl3溶液中加入氨水制Al(OH)3:Al3++3OH-=Al(OH)3↓ |
| D、向FeI2溶液中加入盐酸和过量的H2O2:2I-+H2O2+2H+=I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35Cl2与37Cl2互为同位素 |
B、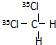 和 和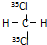 互为同分异构体 互为同分异构体 |
| C、与37Cl的得电子能力相同 |
| D、35Cl-和与它核外电子排布相同的微粒化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原溶液的浓度为0.1mol/L |
| B、反应后溶液中c(Fe3+)=0.1mol/L |
| C、原溶 液中c(Br?)=0.4mol/L |
| D、反应后溶液中c(Fe3+)=c(Fe2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 向1,2两试管中分别加入等浓度H2O2溶液10 mL、1 mL,再向H2O2溶液中分别滴入等浓度等体积CuSO4、FeCl3溶液;试管2中产生气体较快 | 证明FeCl3溶液的催化效率 更高 |
| B | 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
| C | 测定物质的量浓度相同的盐酸和醋酸溶液的pH;盐酸pH小于醋酸pH | 证明盐酸酸性比醋酸强 |
| D | 取5 mL,0.1mol/L的AgNO3溶液于试管中,向试管中加入1-2滴0.1mol/L的NaCl溶液,出现白色沉淀,再向该试管中加入2滴0.1mol/L的KI溶液,出现黄色沉淀(AgI沉淀为黄色). | 证明: Ksp(AgI)<Ksp(AgCl) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com