
【题目】计算题(写出计算过程)
在标准状态下,有体积为4.48L的氯化氢,溶于水得到1L溶液(为盐酸)。请计算:
(1)该盐酸中HCl的物质的量是多少?
_________________
(2)Cl-物质的量是多少?溶液H+物质的量浓度是多少?
_________________
(3)若该盐酸密度为ρ g/cm3,则溶质的质量分数为多少?(用含ρ式子表示)
_________________
【答案】4.48L 的氯化氢的物质的量为![]() =0.02mol ;该盐酸的物质的量为
=0.02mol ;该盐酸的物质的量为![]() , 则n(Cl-)=0.02mol, c(H+)=0.02mol/L;根据
, 则n(Cl-)=0.02mol, c(H+)=0.02mol/L;根据![]() 可知,该盐酸中HCl的质量分数为
可知,该盐酸中HCl的质量分数为![]() ,
,
答:该盐酸的物质的量为0.02mol;Cl-物质的量为0.02mol,溶液H+物质的量浓度为0.02mol/L;该盐酸的溶质质量分数为![]()
【解析】
试题根据n=![]() 计算HCl的物质的量,再根据c=
计算HCl的物质的量,再根据c=![]() 计算盐酸的物质的量浓度以及Cl-物质的量、H+物质的量浓度;根据c=
计算盐酸的物质的量浓度以及Cl-物质的量、H+物质的量浓度;根据c=![]() 进行变形计算该盐酸中HCl的质量分数。
进行变形计算该盐酸中HCl的质量分数。
解:(1)4.48L的氯化氢的物质的量为![]() ;
;
(2)该盐酸的物质的量为![]() , 则n(Cl-)="0.02mol," c(H+)=0.02mol/L;
, 则n(Cl-)="0.02mol," c(H+)=0.02mol/L;
(3)根据![]() 可知,该盐酸中HCl的质量分数为
可知,该盐酸中HCl的质量分数为![]() ,
,
答:该盐酸的物质的量为0.02mol;Cl-物质的量为0.02mol,溶液H+物质的量浓度为0.02mol/L;该盐酸的溶质质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左侧充入1 mol N2,右侧充入CO和CO2的混合气体共8 g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是
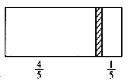
A. 右侧CO与CO2分子数之比为1∶3
B. 右侧气体密度是相同条件下氢气密度的18倍
C. 右侧CO的质量为1.75 g
D. 若隔板处于距离右端1/6处,其他条件不变,则前后两次压强之比为25∶24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列合成路线合成镇痛药芬太尼:
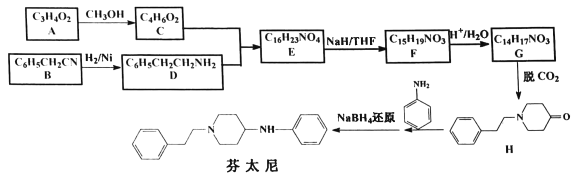
已知:![]()
请回答:
(1)化合物C的结构简式是________。
(2)下列说法正确的是_________。
A.B→D的反应类型为加成反应
B.F和G都能与碳酸氢钠溶液反应
C.芬太尼的分子式为C19H23N2
D.将A→C过程中的CH3OH改为C2H5OH,对芬太尼的结构无影响
(3)写出E→F的化学方程式__________________。
(4)写出符合下列条件的H的所有同分异构体________。
①含有![]() ②含
②含![]() 结构,且此环上无其它支链
结构,且此环上无其它支链
③苯环上的一氯代物只有2种
(5)已知: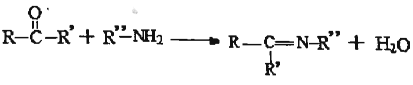 ,设计以环己酮(
,设计以环己酮(![]() )和苯胺(
)和苯胺(![]() )为原料合成有机物
)为原料合成有机物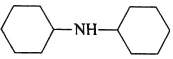 (用流程图表示,其他无机试剂任选)。_____
(用流程图表示,其他无机试剂任选)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故或药品的处理正确的是( )
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.当出现CO中毒时,应立即将中毒者抬到室外新鲜空气处
C.制取并收集氧气结束后,应立即停止加热
D.将含硫酸的废液倒入水槽,用水冲入下水道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示装置的判断,叙述正确的是( )

A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中的电子流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。

I.如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,各加入生铁块,放置一段时间均被腐蚀,这两种腐蚀都属于_________腐蚀。(填“化学腐蚀”或“电化学腐蚀”)
(1)红墨水柱两边的液面变为左低右高,则______(填“a”或“b”)边盛有食盐水。
(2)b试管中铁发生的是______腐蚀,(填“析氢腐蚀”或“吸氧腐蚀”)生铁中碳上发生的电极反应式___________。
Ⅱ.下图装罝的盐桥中盛有饱和NH4NO3琼脂溶液,能够连接两份电解质溶液,形成闭合回路:

(1)该装置的能量转化形式为:__________,装置工作时,盐桥中的NH4+移向 __________。(“CuSO4溶液”或“AgNO3溶液”)
(2)若将盐桥换成铜丝,电路中也有电流通过,则铜丝左端为_________极,该极反应式为:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。下列叙述中错误的是

A. 电池工作时负极材料是Li,发生氧化反应
B. 将电解质溶液改为LiCl的水溶液,电池性能会更好
C. 电池工作时电子流向:锂电极→导线→负载→碳棒
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e=2Cl+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是 )
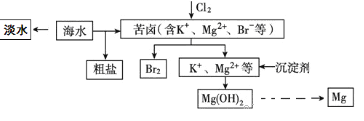
A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
B. 空气吹出法是工业规模海水提溴的常用方法。其工艺的其中一个环节是把氯气通入酸化的浓缩海水(或苦卤)中。
C. 在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂。
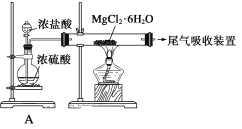
D. 由Mg(OH)2可以制得MgCl2·6H2O,某兴趣小组同学设计了如下装置制取无水MgCl2。其中装置A的作用是制取干燥的HCl气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷能形成多种含氧酸。
(1)次磷酸(H3PO2)是一种精细化工产品,向10 mL H3PO2溶液中加入10 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子。
① 写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式:_______,该正盐溶液中各离子浓度由大到小的顺序为____________。
② 若25℃时,K (H3PO2) = 1×10-2,则0.01 mol · L-1的H3PO2溶液的pH =________。
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1= 1×10-2、K2=2.6×10-7。
① 试从电离平衡移动的角度解释K1、K2数据的差异_______________。
② NaH2PO3溶液显______性(填“酸”“碱”或“中”)。
(3) 25 ℃时,HF的电离常数为K = 3.6×10-4; H3PO4的电离常数为K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。足量NaF溶液和H3PO4溶液反应的离子方程式为_________。
(4)相同温度下,等物质的量浓度的上述三种磷的含氧酸中。c(H+)由大到小的顺序为_____(用酸的分子式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com