
| A. | Ca2CO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | ||
| C. | Cu+4HNO3(稀)═Cu(NO3)2+2NO↑+2H2O | D. | NaCl+AgNO3═AgCl↓+NaNO3 |
分析 属于氧化还原反应,说明该反应中有电子转移,其特征是有元素化合价升降,以此解答该题.
解答 解:A.Ca2CO3+2HCl═CaCl2+H2O+CO2↑中各元素化合价不变,所以不属于氧化还原反应,属于复分解反应,故A错误;
B.H、O元素化合价发生变化,属于氧化还原反应,故B正确;
C.Cu、N元素化合价发生变化,属于氧化还原反应,故C正确;
D.NaCl+AgNO3═AgCl↓+NaNO3中各元素化合价不变,所以不属于氧化还原反应,故D错误;
故选BC.
点评 本题考查了氧化还原反应判断,为高频考点,根据元素化合价变化来分析解答即可,知道常见元素化合价及常见反应类型,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需浓硫酸的体积 | 需取浓硫酸(1.7)mL |
| (2)量 取浓硫酸 | 需要用到的主要仪器是:5mL量筒 |
| (3)将 浓硫酸沿着玻璃棒缓缓注入盛有水的烧杯中并搅拌 | 该操作要做到胆大心细,杜绝事故发生 |
| (4)待溶液冷却至室温,将烧杯中溶液转移至250mL容量瓶中 | 要注意把洗涤液一并转移至容量瓶中 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处后的正确操作是:改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④②① | B. | ①②③④ | C. | ④③②① | D. | ④①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由不同种元素原子形成的共价键 | |
| B. | 由同种元素的两个原子形成的共价键 | |
| C. | 分子中必定含有极性键 | |
| D. | 共同电子对必然偏向吸引电子能力强的原子一方 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
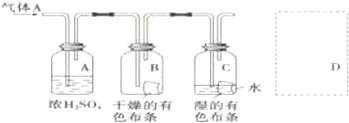
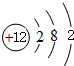 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$先增大再减小 | |
| B. | c(NH4+)与c(NH3•H2O)之和始终保持不变 | |
| C. | 水的电离程度始终增大 | |
| D. | 当加入CH3COOH的体积为10mL时,c(NH4+)=c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com