
A、甲醛的电子式: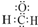 | ||||
B、用铜电极电解盐酸溶液:2H++2Cl
| ||||
C、溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-
| ||||
| D、澄清石灰水中加入过量的小苏打溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
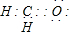 ,故A错误;
,故A错误;
| ||
| △ |


科目:高中化学 来源: 题型:
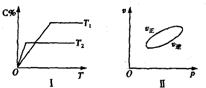 可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )| A、T1<T2,Q>0 |
| B、增大压强,物质B的转化率减小 |
| C、至反应达平衡时,混合气体的密度会变化 |
| D、a+b>c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.00 mol NaCl中含有6.02×1023个NaCl分子 |
| B、1.00 mol NaCl中,所有Na+的最外层电子总数为10×6.02×1023 |
| C、欲配置1.00L、1.00 mol.L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
| D、1mol Fe与稀硫酸反应Fe失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B、等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
| C、常温常压下28 g CO与22.4 L O2所含分子数相等 |
| D、16 g CH4与18 g NH所含质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷中滴入硝酸银溶液检验其中的溴元素:Ag++Br-=AgBr↓ | ||||
| B、14g乙烯燃烧生成液态水产生b kJ热量,则表示其燃烧热的热化学方程式为:C2H4(g)+3 O2(g)═2 H2O(g)+2 CO2(g)△H=-2 b kJ?mol-1 | ||||
C、用惰性电极电解饱和KCl溶液:2 H++2 Cl-
| ||||
| D、硫酸亚铁与双氧水、稀H2SO4混合:2 Fe2++H2O2+2 H+=2 Fe3++2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 |
| B、Na2O2与水反应、红热的Fe与水蒸气反应均生成碱 |
| C、Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物 |
| D、CO2、HCl、NH3的水溶液都能导电,它们均属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含碳原子数比为1:1 |
| B、体积比为11:7 |
| C、密度比为7:11 |
| D、分子数比为7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com