
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
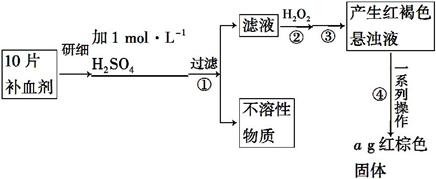
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加 ,该过程的现象为__________________________________________。
(2)步骤②加入过量H2O2的目的是 _____________________________________。
(3)步骤③中反应的离子方程式是 _____________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________ 、灼烧、 、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为 g。
(1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加KSCN溶液,再滴加氯水(或双氧水、稀硝酸等),若滤液由浅绿色变为红色,则说明滤液中含有Fe2+。
(2)由于H2O2具有氧化性,加入过量H2O2的目的是将Fe2+全部氧化为Fe3+。
(3)步骤③的目的是将Fe3+全部转化为Fe(OH)3,所以步骤③需加入过量的NaOH溶液或氨水,反应的离子方程式是:Fe3++3OH-====Fe(OH)3↓[或Fe3++3NH3·H2O====
Fe(OH)3↓+3N ]。
]。
(4)步骤④的目的是将产生的红褐色悬浊液分离,最终得到固体Fe2O3,所以步骤④的操作步骤是过滤、洗涤、灼烧、冷却、称量。
(5)由于实验中铁无损耗,根据铁元素守恒得,每片补血剂中m(Fe)=( )÷10 g=0.07ag。
)÷10 g=0.07ag。
答案:(1)氯水(或双氧水、稀硝酸等合理氧化剂) 溶液由浅绿色变为红色
(2)将Fe2+全部氧化为Fe3+
(3)Fe3++3OH-====Fe(OH)3↓
[或Fe3++3NH3·H2O====Fe(OH)3↓+3N ]
]
(4)洗涤 冷却
(5)0.07a


科目:高中化学 来源: 题型:
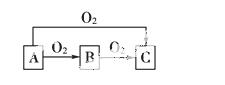 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则B的化学式为________,A→C反应的化学方程式为______________________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为________,B→C反应的化学方程式为__________________。
A和C是否可以反应________,若能,写出反应的化学方程式,若不能,此空不填______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中,溶液里无固体析出的是( )
A.MgCl2溶液中加入Na的小颗粒
B.Ca(OH)2饱和溶液中加入Na的小颗粒
C.KNO3稀溶液中加入Na的小颗粒
D.水中加入Na的小颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种化合物均含有同一种短周期常见金属元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E易溶于水。若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片)。
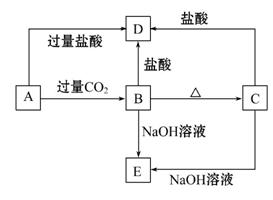
(1)写出化学式:A ,B ,C ,
D ,E 。
(2)写出下列反应的离子方程式:
A→B: _________________________________。
A→D: ________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用毛笔蘸取少量30% FeCl3溶液在铜片上写一个“Cu”字,放置片刻,用少量水将铜片上的溶液冲到小烧杯中,下列说法正确的是( )
A.烧杯中的溶液呈黄色
B.铜片无任何变化
C.铜片上有凹陷的“Cu”字
D.发生了反应:Fe3++Cu====Cu2++Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是 ( )
A.A>B>C>D>E B.A>C>D>B>E
C.C>A>B>D>E D.B>D>C>A>E
查看答案和解析>>
科目:高中化学 来源: 题型:
查处酒后驾驶采用的“便携式乙醇测量仪”
以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其
中一个电极的反应式为:CH3CH2OH—2e—→X+ 2H+.下列说法中正确的是( )
2H+.下列说法中正确的是( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2+4e—+2H2O=4OH—
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH + O2→2CH3CHO + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
为充分利用海洋资源,研究人员发明海水电池,这
种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表 示为:
示为:
5MnO2+2Ag+2NaCl=Na2 Mn5O10+2AgCl
Mn5O10+2AgCl
下列说法错误的是
A.负极反应式: Ag+Cl——e-=AgCl B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Cl—不断向电池的正极移动 D.Na2Mn5O10是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
右图中,两电极上发生的电极反应分别为:
a极:Ag++e-=Ag b极:Fe-2e-=Fe2+
下列说法不正确的是( )
A.a、b可能是同种电极材料
B.该装置一定是电解池
C.装置中电解质溶液一定含有Ag+
D.装置中发生的反应方程式一定是Fe+2Ag+===Fe2++2Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com