
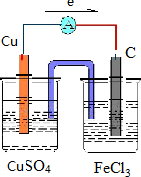
 ,电子从铜极流向碳极,
,电子从铜极流向碳极, .
.


科目:高中化学 来源: 题型:
| A、H2SO3?2H++SO32- |
| B、HF=H++F- |
| C、NaHS=Na++H++S2- |
| D、H2CO3+H2O?H3O++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
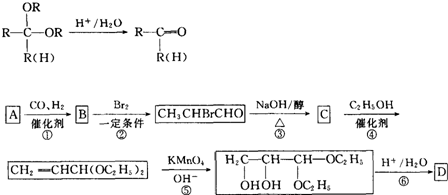
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
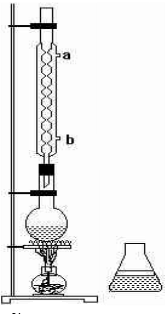
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在制备乙烯的实验中,为了防止反应产生副产物,加热时应使温度迅速上升至170°C |
| B、分别向三支盛有乙酸乙酯的试管中加入氢氧化钠溶液、稀硫酸、水,并在水浴中加热,乙酸乙酯香味散失的速度按氢氧化钠、水、稀硫酸的顺序依次减慢 |
| C、将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 |
| D、向苯酚钠稀溶液中,通入少量二氧化碳气体,溶液中生成碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeCl2 溶液中逐滴加入NaOH溶液 |
| B、向FeSO4溶液中逐滴加入氨水 |
| C、先将盛有NaOH溶液的长滴管插到FeSO4液面下,再挤出NaOH溶液可制得Fe(OH)2的白色沉淀 |
| D、取新配制的FeSO4溶液适量放入试管中,在加入一层植物油(密度小于水,且不溶于水),然后向试管内逐滴加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
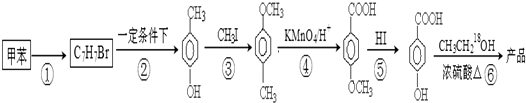
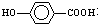 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)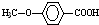 的同分异构体很多,其中符合下列条件有
的同分异构体很多,其中符合下列条件有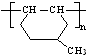 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com