
| A. | 麦芽糖和蔗糖 | B. | 蛋白质和氨基酸 | C. | 油和脂 | D. | 淀粉和纤维素 |
分析 分子式相同、结构不同的化合物之间互为同分异构体,注意同分异构体必须具有相同的分子式、不同的结构,据此进行解答.
解答 解:A.麦芽糖和蔗糖的分子式相同、结构不同,二者互为同分异构体,故A正确;
B.蛋白质水解的最终产物为氨基酸,蛋白质与氨基酸的分子式不同,二者不属于同分异构体,故B错误;
C.油为不饱和高级脂肪酸甘油酯,脂为饱和高级脂肪酸甘油酯,二者的分子式不同,不属于同分异构体,故C错误;
D.淀粉和纤维素都属于高分子化合物,二者没有固定的分子式,所以不属于同分异构体,故D错误;
故选A.
点评 本题考查了同分异构体的判断,题目难度不大,明确同分异构体的书写原则为解答关键,注意高分子化合物没有固定的分子式,一定不属于同分异构体,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 我国目前使用的主要能源是化石能源 | |
| B. | 氢能源的优点有:热量值高、对环境友好 | |
| C. | 核能发电是解决能源危机的最佳途径 | |
| D. | 太阳能的缺点有:能量密度低、稳定性差 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
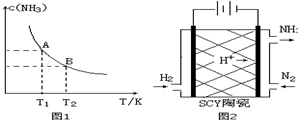
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
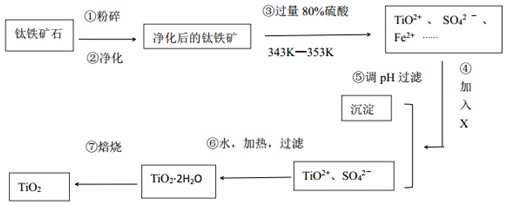
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
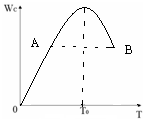 对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4只做还原剂 | |
| B. | 10mol CuSO4可氧化P的物质的量为2mol | |
| C. | Cu3P既是氧化产物,又是还原产物 | |
| D. | 生成1mol Cu3P时,被氧化的P的物质的量为2.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.21 g氯化钠 | B. | 用10 mL量筒量取7.50 mL稀硫酸 | ||
| C. | 用25 mL滴定管量取14.86 mL溶液 | D. | 用广泛pH试纸测得溶液的pH为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
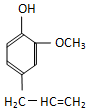 某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如图所示,请回答:
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如图所示,请回答: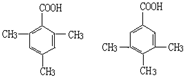 中的一种.
中的一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com