
����Ŀ��һ���¶��£���1L�����ܱ������м���lmol��N2(g)��3molH2(g)������Ӧ��N2(g)+3H2(g) ![]() 2NH3(g) ��H<0�� NH3�����ʵ�����ʱ��Ĺ�ϵ���±���ʾ������˵���������
2NH3(g) ��H<0�� NH3�����ʵ�����ʱ��Ĺ�ϵ���±���ʾ������˵���������
ʱ��(min) | 0 | t1 | t2 | t3 |
NH3���ʵ���(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min��v(NH3)=![]() mol��L-1��min-1
mol��L-1��min-1
B. �����¶ȣ���ʹ����Ӧ���ʼ�С���淴Ӧ��������ƽ������
C. N2(g)+3H2(g) ![]() 2NH3(g)�Ļ��С��2NH3(g)
2NH3(g)�Ļ��С��2NH3(g) ![]() N2(g)+3H2(g)�Ļ��
N2(g)+3H2(g)�Ļ��
D. t3ʱ�ټ���1mol��N2(g)��3molH2(g)����Ӧ����ƽ��ʱ��c(N2)>0.85mol��L-1
���𰸡�B
��������A��0t1min��v(NH3)= 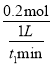 =
=![]() mol��L-1��min-1����A��ȷ��B�������¶ȣ������淴Ӧ���ʾ�����B����C��N2(g)+3H2(g)
mol��L-1��min-1����A��ȷ��B�������¶ȣ������淴Ӧ���ʾ�����B����C��N2(g)+3H2(g) ![]() 2NH3(g)�Ƿ��ȷ�Ӧ��������Ӧ�Ļ��С���淴Ӧ�Ļ�ܣ���C��ȷ��D��1mol��N2(g)��3molH2(g)����Ӧ����ƽ��ʱ��NH3(g)�ı仯��Ϊ0.3mol����N2�ı仯��Ϊ0.15mol��ƽ��ʱc(N2)=0.85mol��L-1���ټ���1mol��N2(g)��3molH2(g)��ƽ�������ƶ���������������ԭ������Ӧ����ƽ��ʱ��c(N2)>0.85mol��L-1����D��ȷ����ΪB��
2NH3(g)�Ƿ��ȷ�Ӧ��������Ӧ�Ļ��С���淴Ӧ�Ļ�ܣ���C��ȷ��D��1mol��N2(g)��3molH2(g)����Ӧ����ƽ��ʱ��NH3(g)�ı仯��Ϊ0.3mol����N2�ı仯��Ϊ0.15mol��ƽ��ʱc(N2)=0.85mol��L-1���ټ���1mol��N2(g)��3molH2(g)��ƽ�������ƶ���������������ԭ������Ӧ����ƽ��ʱ��c(N2)>0.85mol��L-1����D��ȷ����ΪB��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������÷�Һ©���ֿ����ǣ������Ȼ�̼��ˮ ���Ҵ������� �� �Ҵ���ˮ ������ˮ �����顢ˮ �������顢�� ���屽��ˮ
A���ڢۢ� B���٢ڢ� C���٢ܢݢ� D���ܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. �����������ȷ�Ӧұ�����۵�Ľ���
B. �ִ�ʯ�ͻ���������������������ʵ��һ�������ϩת��Ϊ��������Ĺ��̣��÷�Ӧ��ԭ��������Ϊ100%
C. ��ҵ�����������ữ��Ũ����ˮ��ֱ��ͨ�������û����弴��
D. úֱ��Һ���ɵ�Һ��ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ�Ҳ��һ�����ʵ�ȼ�ϡ�
��.�״�������ȡ��ȩ��ԭ��ΪCH3OH(g)![]() HCHO(g) +H2(g)��ij����С����2 L�ܱ������г���1 mol CH3OH���Ը÷�Ӧ������һϵ�е��о����õ��״���ƽ��ת�������¶ȵı仯������ͼ��ʾ��
HCHO(g) +H2(g)��ij����С����2 L�ܱ������г���1 mol CH3OH���Ը÷�Ӧ������һϵ�е��о����õ��״���ƽ��ת�������¶ȵı仯������ͼ��ʾ��
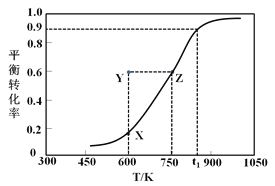
��1������ѡ���У���˵���÷�Ӧ�ﵽƽ��״̬����__________��
a��v(CH3OH) =v(HCHO) b��H2������������ٱ仯
c����ȩ�������������ٸı� d����������ܶȲ���
��2����t1ʱ���÷�Ӧ��ƽ�ⳣ��ΪK=________________�����¶��£��ӷ�Ӧ��ʼ��ƽ����������ʱ��Ϊ5 s����v(HCHO)Ϊ_______mol/(L��min)�������������ͨ��1.1 mol CH3OH��1.1 mol H2����ƽ����_________�������Ӧ�����淴Ӧ���������ƶ���
��3��600 Kʱ��Y��״���v(��)_______v(��) (�>������<����=��)��������_____________________��
��.��֪��CH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ��H1=��a kJ/mol��
2Cu(s)+O2(g)=2CuO(s) ��H2=��b kJ/mol��
��4������ͭ������ʱ��2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ��H3=______kJ/mol���ú�a��b�Ĵ���ʽ��ʾ����
��.��ͼ��ʾ����NaOH��ҺΪ�������Һ�ļ״�ȼ�ϵ�أ�

��5��a���缫��ӦʽΪ__________________________������ĤΪ�����ӽ���Ĥ�����ع���һ�κ�ظ�������Һ��n(OH��)_____�����������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йر�ϩ�ᣨCH2=CHCOOH����˵����ȷ����
A. ��ϩ��ʹ��ˮ��ɫ����������Ӧ
B. ��ϩ���ܷ����ӳɷ�Ӧ�����ܷ���ȡ����Ӧ
C. ��ϩ�����������̼ԭ�Ӳ����ܴ���ͬһƽ��
D. ��Ӧ CH2=CHCOOH+H2![]() CH3CH2COOH��ԭ��������Ϊ100%
CH3CH2COOH��ԭ��������Ϊ100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ż�����Ⱦ�ļ��غ����ǻ�����ʶ�ļ�ǿ�����オ��������ܵ������ǵĹ�ע��������PBA (�������オ������߷��Ӳ��ϣ��ĺϳ�·�ߣ�

��֪������A����Է�������Ϊ84���˴Ź���������ʾֻ��1��壬����ʹ������Ȼ�̼��Һ��ɫ��
�ڻ�����C��ֻ��һ�������š�
��R1CH=CHR2![]() R1COOH+R2COOH
R1COOH+R2COOH
��
(1)��A����B�ķ�Ӧ����Ϊ_________��
(2)��B����C�Ļ�ѧ����ʽΪ__________��
(3)E�Ľṹ��ʽΪ______________________��
(4)F������Ϊ______________(��ϵͳ������)����D������PBA�Ļ�ѧ����ʽΪ_______________����PBA��ƽ���ۺ϶�Ϊ70������ƽ����Է�������Ϊ___________��
(5)E��ͬ���칹������ͬʱ�������������Ĺ���_____�֣����������칹����
����״������ ���ܷ���������Ӧ ����ԭ�Ӳ���̼̼˫��ֱ������
���У��˴Ź���������ʾΪ2��壬�ҷ������Ϊ2:1����_________(д�ṹ��ʽ)��
(6)����1.3������ϩΪԭ�ϣ��������Լ���ѡ��ͨ�������Ʊ�������F����ϳ�·��Ϊ:___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2H(g)+Y(g)![]() 2I(g)��Ӧ����t��ʱ����һѹǿ�㶨���ܱ������У�����4 mol H��2 mol Y��Ӧ���ﵽƽ���Yʣ��0.2 mol�����������ƽ����ϵ�У��ټ���1 mol��̬��I���ʣ�t ��ʱ�ﵽ�µ�ƽ�⣬��ʱH���ʵ����ʵ���n(H)Ϊ( )
2I(g)��Ӧ����t��ʱ����һѹǿ�㶨���ܱ������У�����4 mol H��2 mol Y��Ӧ���ﵽƽ���Yʣ��0.2 mol�����������ƽ����ϵ�У��ټ���1 mol��̬��I���ʣ�t ��ʱ�ﵽ�µ�ƽ�⣬��ʱH���ʵ����ʵ���n(H)Ϊ( )
A��0.2mol B��0.5 mol C��0.6 mol D��0.8 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����11�֣���2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g) ![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����ƽ���ʱ���� �������� ��
��2����ͼ�б�ʾNO2�ı仯�������� ����O2��ʾ��0~2 s�ڸ÷�Ӧ��ƽ������v= ��
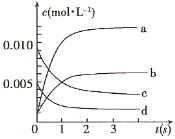
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
a��v(NO2) = 2v(O2) b�������ڸ����ʵ�Ũ�ȱ��ֲ���
c��v��(NO) = 2v��(O2) d���ﵽ��ѧƽ��ʱ��NO����ȫת��ΪNO2
��4��������÷�Ӧ�ķ�Ӧ������ ��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A�Ļ�ѧʽΪNH5����������ԭ�ӵ�������Ӳ�ṹ��������Ӧϡ�������������Ӳ�ṹ���������й�˵������ȷ����( )
A. 1 mol NH5�к���5NA��N��H��(NA��ʾ�����ӵ���������ֵ)
B. NH5�м��й��ۼ��������Ӽ�
C. NH5�ĵ���ʽΪ![]()
D. NH5��ˮ��Ӧ�����ӷ���ʽΪNH![]() ��H����H2O===NH3��H2O��H2��
��H����H2O===NH3��H2O��H2��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com