
 实验室用0.10mol?L-1的NaOH溶液滴定某一元弱酸HA的滴定曲线如图所示,图中横轴为滴入的NaOH溶液的体积V(mL),纵轴为溶液的pH,下列叙述不正确的是( )
实验室用0.10mol?L-1的NaOH溶液滴定某一元弱酸HA的滴定曲线如图所示,图中横轴为滴入的NaOH溶液的体积V(mL),纵轴为溶液的pH,下列叙述不正确的是( )| A、此一元弱酸HA的电离平衡常数Ka≈1×10-4mol?L-1 |
| B、此弱酸的起始浓度约为1×10-2mol?L-1 |
| C、此实验最好选用酚酞试液(变色范围8.0~10.0)做指示剂 |
| D、当混合液pH=7时,溶液中c(HA)>c(A-) |
| 10-4×10-4 |
| 10-2 |


科目:高中化学 来源: 题型:
| A、Na2CO3是碳酸盐 |
| B、Na2CO3是正盐 |
| C、Na2CO3是钠盐 |
| D、Na2CO3是碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ca2+、Cl-、HCO3- |
| B、Na+、Fe3+、Cl-、HCO3- |
| C、Fe2+、Fe3+、Cl-、NO3- |
| D、Fe2+、Mg2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入合金的质量可能为3.2g |
| B、参加反应的硝酸的物质的量为0.4mol |
| C、沉淀完全时消耗NaOH的物质的量为0.3mol |
| D、还原产物的体积范围2.24L<V还原产物<6.72L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、0.5 mol?L-1 |
| B、0.1 mol?L-1 |
| C、1 mol?L-1 |
| D、1.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
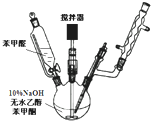 (1)制备过程中(如图),需在搅拌下滴加苯甲醛,并控制滴加速度使 反应温度维持在25~30℃,说明该反应是
(1)制备过程中(如图),需在搅拌下滴加苯甲醛,并控制滴加速度使 反应温度维持在25~30℃,说明该反应是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增重的4.4g为参加反应的CO2的质量 |
| B、溶质为Na2CO3 |
| C、溶质为NaHCO3 |
| D、低温蒸干溶液,所得固体的质量为:原溶液中NaOH的质量+4.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com