
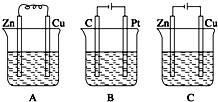
 如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.
如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.
| ||


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、pH逐渐减小 | ||||
B、
| ||||
| C、水的电离程度会不断增大 | ||||
| D、Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合金的熔点一般比它的各成分金属的熔点低 |
| B、合金的硬度一般比它的各成分金属的硬度大 |
| C、合金的性质一般是各成分金属性质的总和 |
| D、合金在工业上的用途比纯金属更广 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列物质中可以作为燃料电池的负极反应物的是
(1)下列物质中可以作为燃料电池的负极反应物的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.
﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com