
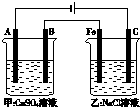
 如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
| ||
| ||
| 25.6 |
| 64 |
| ||
| 0.8mol/L |
| 0.4L |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体粒子直径在lnm~100nm |
| B、遇BaCl2溶液或Fe(OH)3胶体可发生聚沉 |
| C、电泳时,该胶体向阴极方向移动 |
| D、Na+使此胶体凝聚的效果不如Ca2+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓盐酸和铁屑反应:2Fe+6H+═2Fe3++3H2 ↑ |
| B、碳酸钙与醋酸的反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、用澄清的石灰水吸收过量的CO2:CO2+OH-═HCO3- |
| D、向NaHSO4溶液中加入Ba(OH)2 使SO42-恰好完全沉淀:Ba2++2OH-+2H++SO42-═BaSO4 ↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验装置 | 实验现象 |
| 步骤1:将干燥的红布条投入到装有干燥氯气的集气瓶 | 发现有色布条不褪色 |
| 步骤2:将新制的饱和氨水等分成两份分装于A、B两试管 |  |
| 步骤3:向B中加入足量NaHCO3固体 |  |
| 步骤4:同时向A、B两试管加入相同大小的红布条,观察褪色的先后顺序 | B试管褪色所需时间短 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com