
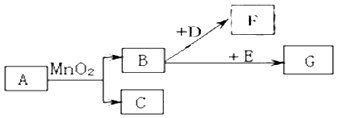
分析 根据A-G是初中常见的几种物质,A、C是无色液体且含有的元素种类相同,则A和二氧化锰会生成水和氧气,所以A是双氧水,C为水,B是氧气,D是黑色固体,B、F是无色气体,氧气和D会生成二氧化碳,所以D就是碳,F是二氧化碳,E在纯净的B中燃烧火星四射,同时产生G,所以E是铁,G为四氧化三铁,铁丝在氧气中燃烧时放出大量的热,能够产生高温的熔化物,如果直接落在集气瓶中会引起集气瓶的炸裂,然后将推出的各种物质代入转化关系中进行验证即可.
解答 解:(1)根据以上分析,A是H2O2,D是C,G是Fe3O4;故答案为:H2O2;C;Fe3O4;
(2)A→B的反应是过氧化氢在二氧化锰的催化作用下生成水和氧气,表达式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,该反应属于分解反应;故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(3)B→G的反应是铁和氧气点燃,剧烈燃烧,火星四射,放出大量的热,生成黑色固体.防止生成的熔融物炸裂瓶底,在瓶底铺一层细沙或盛少量水;故答案为:防止生成物溅落炸裂集气瓶底部;
(4)F物质为二氧化碳,在大气中排放过多会引起温室效应.
故答案为:温室效应.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5molC3H8分子中所含C-H共价键数为2NA | |
| C. | 标准状况下,22.4L乙醇完全燃烧所消耗的氧气分子数为3NA | |
| D. | 1molCH5+离子所含的电子数为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | FeS | MnS | HgS |
| 溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2、Br2、Cl2 | B. | Na+、K+、Cs+ | C. | Cl-、Br-、I- | D. | Al3+、Mg2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2;△H3<△H4 | B. | △H1>△H2;△H3>△H4 | C. | △H1=△H2;△H3<△H4 | D. | △H1<△H2;△H3>△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCl2发生反应转移的电子数一定为0.2NA | |
| B. | 标准状况下,11.2L三氧化硫晶体含有的分子数为0.5NA | |
| C. | 标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA | |
| D. | 1L0.1mol/L的氨水中含OH-离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O;c(NH4+) 由大到小的顺序是:①>②>③>④ | |
| C. | 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com