
碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。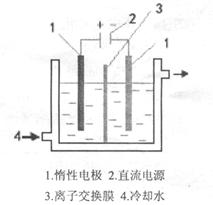
(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应 ;阴极上得到的气体产物为 ;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为 ,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
| 实验操作 | 现象及结论 |
| | |
(1)5:1
(2)I-+6OH--6e-=IO3-+3H2O 氢气
(3)IO3-+ 5I-+6H+=3I2+3H2O
【实验操作】取少量阳极区电解液于试管中,加稀硫酸酸化后,加入几滴淀粉 溶液,观察是否变蓝
【现象及结论】如果不变蓝,说明没有I-(如果变蓝,说明有I-)
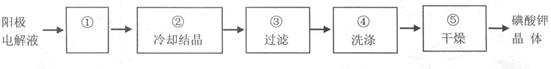
(4)蒸发浓缩,洗去吸附在碘酸钾晶体表面的氢氧化钾等杂质
解析试题分析:(1)碘元素由0价升为+5价,则I2是还原剂,KIO3是氧化产物,碘元素还由0价降为—1价,则I2还是氧化剂,KI是还原产物;根据系数之比等于物质的量之比,由于氧化产物KIO3为1mol,则还原剂I2为1/2mol,还原产物KI为5mol,则氧化剂I2为5/2mol,所以该反应中氧化剂和还原剂的物质的量之比为5/2∶1/2=5∶1;(2)阳极发生氧化反应,根据题意可知其主要反应物和产物是I―→IO3―;碘元素由—1价升为+5价,根据化合价升高总数等于失去电子数可知,I―—6e―→IO3―;根据KOH溶液显碱性可知,应用OH―使左右电荷守恒,则I―—6e―+6OH―→IO3―;根据氢或氧原子个数守恒可知,I―—6e―+6OH―=IO3―+3H2O;溶液中的阳离子移向阴极,H+优先得到电子,发生还原反应,产生氢气,则阴极得到的气体产物是H2;(3)碘元素由+5价降为0价,说明KIO3是氧化剂,I2是还原产物,碘元素由—1价升为0价,说明I―是还原剂,I2还是氧化产物;根据化合价升降总数相等,则IO3―+5I―→3I2;酸性介质中可用H+使左右电荷守恒,则IO3―+5I―+6H+→3I2;根据氢或氧原子守恒可知,该反应为IO3―+5I―+6H+=3I2+3H2O;检验阳极区电解液中I―时,需要借助上述反应中碘离子的氧化产物(碘单质)遇淀粉变蓝的特性,就是要设法使碘离子转化为碘单质;因此实验时先取少量阳极区电解液于试管中,加稀硫酸酸化后,再加入几滴淀粉溶液,观察是否变蓝,若不变蓝,说明无碘离子;若变蓝,说明有碘离子;(4)根据混合物分离提纯的方法可知,从KIO3溶液中制KIO3晶体的过程分别为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,则步骤①为蒸发浓缩;KIO3晶体上吸附着KOH等易溶性杂质,洗涤的目的是除去晶体表面吸附的易溶性杂质。
考点:考查氧化还原反应、电解原理、离子反应原理、实验方案的设计、混合物分离提纯的方法和步骤等。


科目:高中化学 来源: 题型:填空题
某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:
已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是 。(写化学式)
(2)写出第③步反应的离子方程式 。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有 。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:
电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比 为d,则此时的铬酸钾的转化率为 。
为d,则此时的铬酸钾的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(6分)由Zn—Cu—H2SO4组成的原电池,工作一段时间后,锌片的质量减少了6.5g。求:
(1)原电池生成氢气_______L(标准状况)。
(2)已知:1mol氢气完全燃烧放出285.8kJ的热量。将(1)中获得的氢气燃烧,可以得到_________kJ的热量。
(3)若起始时刻两电极质量相等,将电解质溶液改为硫酸铜溶液,当电池输出相同的电量时,电池两极的质量差为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题。煤综合利用的一种途径如下所示:
(1)用如图[(1)小题图]所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2)B中预期的实验现象是 ,D中的试剂是 。

(2)已知① C(s) + H2O(g) = CO(g) + H2 (g) ; ΔH1 =" +131.3" kJ·mol-1
② C(s) + 2H2O(g) = CO2(g) + 2H2(g) ;ΔH2 =" +90" kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(3)用(3)小题图装置可以完成⑤的转化,同时提高能量的利用率。其实现的能量转化形式主要是由 能转化为 能,a的电极反应式是 。
(4)燃煤烟气中的CO2可用稀氨水吸收,不仅可以减少CO2的排放,也可以生产化肥碳酸氢铵。假设该方 法每小时处理含CO2的体积分数为11.2%的燃煤烟气 1000 m3(标准状况),其中CO2的脱除效率为80%,则理论上每小时生产碳酸氢铵 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案不合理的是( )
| A.除去乙烷中含有的乙烯:将气体通入溴水中,洗气 |
| B.检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸。水浴加热5min后取少量溶液,加氢氧化钠溶液调溶液pH至碱性,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象 |
| C.除去乙酸乙酯中的乙酸:加入浓硫酸和乙醇,加热 |
| D.鉴别己烯和苯:将溴的四氯化碳溶液分别滴加到少量己烯和苯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某链状有机物分子中含有m个—CH3 ,n个—CH2—,a个 ,其余为—Cl,则—Cl的数目可能是
,其余为—Cl,则—Cl的数目可能是
| A.2n+3a-m | B.a+2-m | C.n+m+a | D.a+2n+2-m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com