
分析 先根据v=$\frac{△c}{△t}$计算A的平均反应速率,同一可逆反应中同一段时间内,各物质的反应速率之比等于其计量数之比,据此计算B、C反应速率.
解答 解:v(A)=$\frac{△c}{△t}$=$\frac{1.2-0.6}{2}$mol/(L.min)=0.3mol/(L.min),同一可逆反应中同一段时间内,各物质的反应速率之比等于其计量数之比,所以v(B)=$\frac{1}{3}$v(A)=$\frac{1}{3}$×0.3mol/(L.min)=0.1mol/(L.min),v(C)=$\frac{2}{3}$v(A)=$\frac{2}{3}$×0.3mol/(L.min)=0.2mol/(L.min),
故答案为:0.3mol/(L.min);0.1mol/(L.min);0.2mol/(L.min).
点评 本题考查化学反应速率的有关计算,为高频考点,侧重考查学生计算能力,明确化学计量数与反应速率关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 0.4 mol | C. | 0.8 mol | D. | 0.45mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10gH218O与10gD2O所含的中子数均为5NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液所含NH4+数为0.1NA | |
| C. | 2.4gMg在空气中充分燃烧,转移电子数为0.2NA | |
| D. | 100g质量分数为46%的酒精水溶液中含氧原子总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
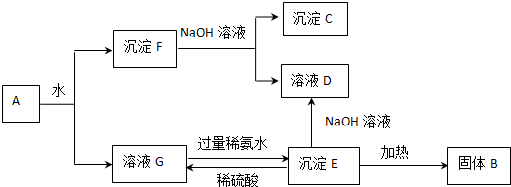
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
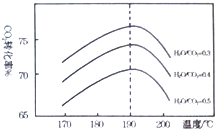 二氧化碳是一种宝贵的碳氧资源.以C02和NH3
二氧化碳是一种宝贵的碳氧资源.以C02和NH3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤③ | B. | ⑥①⑤③ | C. | ⑧①⑦③ | D. | ⑤②⑥③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4℃时,18g 21H2168O中含有电子数为10NA | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 常温下,1L0.1mol•L-1的NH4NO3溶液中所含氮原子数为0.2 NA | |
| D. | 标准状况下,22.4 L的CCl4中C-Cl键数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com